题目内容
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl﹣>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
B.10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+)
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO﹣)>c(OH﹣)>c(H+)
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)
【答案】B
【解析】解:A.物质的量相同的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,但其水解程度较小,所以离子浓度大小顺序是c(Cl﹣>c(NH ![]() )>c(H+)>c(OH﹣),故A错误; B.10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合,二者恰好反应生成氯化钠和一水合氨,一水合氨电离导致溶液呈碱性,c(OH﹣)>c(H+),但其水解程度较小,根据物料守恒得c(Na+)=c(Cl﹣),离子浓度大小顺序是c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+),故B正确;
)>c(H+)>c(OH﹣),故A错误; B.10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合,二者恰好反应生成氯化钠和一水合氨,一水合氨电离导致溶液呈碱性,c(OH﹣)>c(H+),但其水解程度较小,根据物料守恒得c(Na+)=c(Cl﹣),离子浓度大小顺序是c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+),故B正确;
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,二者物质的量相等,二者恰好反应生成醋酸钠,醋酸根离子水解导致溶液呈碱性,所以得c(Na+)>c(CH3COO﹣)、c(OH﹣)>c(H+),但其水解程度较小,离子浓度大小顺序是c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),故C错误;
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,盐酸的物质的量大于醋酸钠,盐酸过量,反应后溶液中溶质为醋酸、氯化钠、盐酸,溶液呈酸性,则c(H+)>c(OH﹣),根据物料守恒得c(Cl﹣)>c(Na+),离子浓度大小顺序是c(Cl﹣)>c(Na+)>c(H+)>c(OH﹣),故D错误;
故选B.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是酸的酸酐,Cl2O电子式为 .
(2)下列能判断Cl和O两种元素非金属性强弱的是(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2 , 其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2﹣)和氯酸盐,其离子方程式是 , 氧化产物 . (填离子符号)
(5)一定条件下,在水溶液中1mol Cl﹣、ClO ![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示).
(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示). 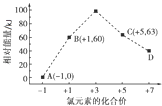
【题目】国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来。下列说法正确的是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2 852 | 714 |
A. 宇航员喝茶时注入的H2O的摩尔质量是18克
B. H2O+Cl2![]() HCl+HClO这反应属于氧化还原反应
HCl+HClO这反应属于氧化还原反应
C. 氢的三种同位素1H、2D、3T与16O只能形成三种水分子
D. 在标准状况下,1mol水的体积约是22.4L