��Ŀ����
����Ŀ����Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣮
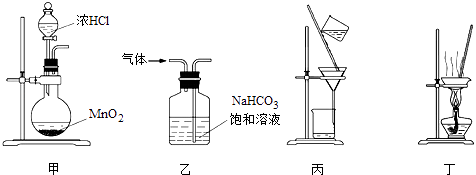
��1���μ�أ����϶�Na2CO3��NaCl��������ֲ�����������÷���ʽ��ʾ���μ�ز������Ե�ԭ����
ũҵ����ʯ�ཱུ������Եķ�Ӧԭ���� ��
��2����֪ˮ��������ƽ�⣺H2O+H2OH3O++OH�� �� ��ˮ�м���NaHSO4���壬ˮ�ĵ���ƽ�����ƶ�����������Һ���ԣ�
��3����ȡpH���������ȵ�NaOH��Һ�Ͱ�ˮ�ֱ���ˮϡ��m����n����ϡ�ͺ�pH����ȣ���mn�����������������=������
��4�������£���pH=6��CH3COOH��CH3COONa�Ļ����Һ��ˮ���������c��OH����= ��
��5����ͼ�л�����0.100 0molL��1 NaOH��Һ�ζ�20.00 mL 0.100molL��1����ĵζ�����ʾ��ͼ �� 
���𰸡�
��1��Na2CO3+H2O?NaHCO3+NaOH��Na2CO3+CaSO4�TCaCO3+Na2SO4
��2��������
��3����
��4��1��10��8mol/L
��5��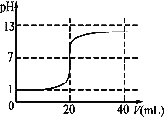
���������⣺��1��̼����ˮ���Լ��ԣ��ʲ���������������ˮ��Ļ�ѧ����ʽΪ��Na2CO3+H2ONaHCO3+NaOH������ʯ�࣬���̼���Ʒ�Ӧ����̼��Ƴ�����������̼�������Ũ�ȣ��������������Խ��ͣ���Ӧ����ʽΪ��Na2CO3+CaSO4�TCaCO3+Na2SO4 �� ���Դ��ǣ�Na2CO3+H2ONaHCO3+NaOH��Na2CO3+CaSO4�TCaCO3+Na2SO4����2���������ƴ���뷽��ʽΪ��NaHSO4=Na++H++SO ![]() �������H+ �� ʹ��Һ�����ԣ�����ˮ�ĵ��룬
�������H+ �� ʹ��Һ�����ԣ�����ˮ�ĵ��룬
���Դ��ǣ��������3��ϡ�ͻ�ٽ�������ʵĵ��룬����ȡpH���������ȵ�NaOH�Ͱ�ˮ�ֱ��ˮϡ��m����nϡ�ͺ�pH����ȣ���ˮϡ�ͱ��������Դ��ǣ�������4��pH=6��CH3COOH��CH3COONa�Ļ����Һ�У�����ĵ���̶ȴ��ڴ�������ӵ�ˮ��̶ȣ�����Һ�����ԣ��û��Һ�е�������������ˮ�ĵ���ģ���ˮ�������c��OH����= ![]() =
= ![]() mol/L=10��8mol/L�����Դ��ǣ�1��10��8mol/L����5���������������Ϊ0ʱ����ҺpHΪ1��������ǡ�÷�Ӧʱ����������������Һ���Ϊ20mL����ʱ��Һ��pH=7���������������ҺpH���������ڼ��pH��13�����ɴ������ζ�����ʾ��ͼΪ��
mol/L=10��8mol/L�����Դ��ǣ�1��10��8mol/L����5���������������Ϊ0ʱ����ҺpHΪ1��������ǡ�÷�Ӧʱ����������������Һ���Ϊ20mL����ʱ��Һ��pH=7���������������ҺpH���������ڼ��pH��13�����ɴ������ζ�����ʾ��ͼΪ��  �����Դ��ǣ�
�����Դ��ǣ�  ��
��
�����㾫����������Ĺؼ������������������ˮ��Һ�еĵ���ƽ������֪ʶ�����յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����

����Ŀ������������(NOx)�Ǵ�����Ⱦ��֮һ����ҵ����һ���¶Ⱥʹ�����������NH3��NOx��ԭ����N2����Ϫһ�л�ѧ��ȤС����ʵ�����ж�NH3��NO2��Ӧ������̽�����ش��������⣺
��1���������Ʊ�
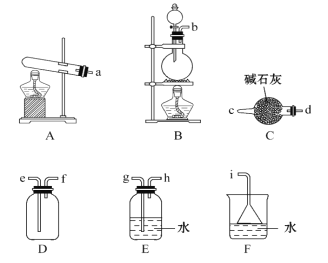
�ٰ����ķ���װ�ÿ���ѡ����ͼ�е�________����Ӧ�Ļ�ѧ����ʽΪ____________________��
�����ռ�һƿ����İ�����ѡ����ͼ�е�װ��,������˳��Ϊ:����װ�á�_____________(������������Сд��ĸ��ʾ)��
��2����������������ķ�Ӧ
�������ռ�����NH3����ע����X��,Ӳ�ʲ�����Y�м�����������������NO2(�����ü���K1��K2�к�)����һ���¶��°�ͼʾװ�ý���ʵ�顣
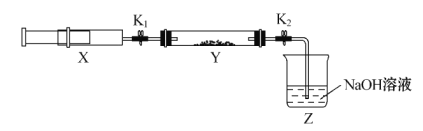
�������� | ʵ������ | ����ԭ�� |
��K1���ƶ�ע����������ʹX�е����建��ͨ��Y���� | ��Y����____________ | �ڷ�Ӧ�Ļ�ѧ����ʽ______���÷�Ӧ�б������ͱ���ԭ�ĵ�Ԫ�ص���������____________ |
��ע���������˻�ԭ�����̶�����װ�ûָ������� | Y����������ˮ�� | ���ɵ���̬ˮ���� |
��K2 | ��____________ | ��______________ |