题目内容
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
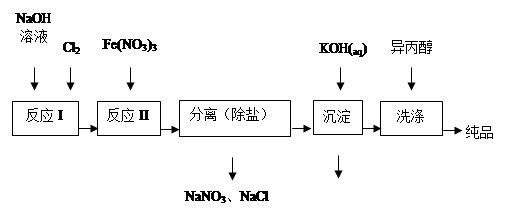 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应I的化学方程式为 。
③反应II的离子方程式为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。②反应I的化学方程式为 。
③反应II的离子方程式为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(共15分,除(1)③3分外其它每空2分)
(1)①减少高铁酸钾的溶解损失(2分)
②2NaOH+Cl2=NaCl+NaClO+H2O(2分)
③3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O(3分)
④3(2分)
(2)①增大K+浓度,促进K2FeO4晶体析出(2分) ②小(2分)
(3)3:1(2分)
(1)①减少高铁酸钾的溶解损失(2分)
②2NaOH+Cl2=NaCl+NaClO+H2O(2分)
③3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O(3分)
④3(2分)
(2)①增大K+浓度,促进K2FeO4晶体析出(2分) ②小(2分)
(3)3:1(2分)
试题分析:
(1)①钾盐易溶于水,用有机溶剂可以避免钾盐的损失
②氯气与氢氧化钠反应生成氯化钠、次氯酸钠、和水。
③上一步反应生成了次氯酸根,作为唯一的氧化剂氧化三价铁离子生成氯离子和高铁酸盐。
④Ksp〔Fe(OH)3〕=c3(OH-)·c(Fe3+)算出,c(OH-)=10-11,根据pH的算法,pH=3.
(2)①Ksp〔K2FeO4〕=c2(K+)·c(FeO42-),故增加钾离子浓度可以析出K2FeO4晶体。
②否则就用同样类似的方法制备Na2FeO4了。
(3)N得到2个电子,Fe 得到3个电子,所以N*3,Fe *2,又因为是Fe2O3(重点是Fe2),故比例为3:1.

练习册系列答案
相关题目

 Cl2↑+H2↑
Cl2↑+H2↑
 Fe3O4+S4O62-+2H2O,有关说法正确的是
Fe3O4+S4O62-+2H2O,有关说法正确的是
 2H2↑+O2↑,下列有关判断正确的是
2H2↑+O2↑,下列有关判断正确的是 CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。