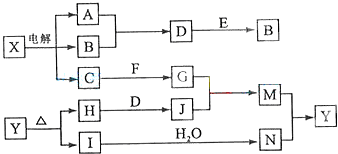
题目内容
11.下列反应中,SO2作还原剂的是( )| A. | 2H2S+SO2═3S↓+2H2O | B. | Cl2+SO2+2H2O═H2SO4+2HCl | ||
| C. | SO2+2Mg═2MgO+S | D. | SO2+2NaOH═Na2SO3+H2O |
分析 在氧化还原反应中,二氧化硫作还原剂,则二氧化硫在反应中失电子化合价升高,以此解答该题.
解答 解:A.该反应中,二氧化硫中硫元素得电子化合价降低,所以二氧化硫是氧化剂,故A错误;
B.S元素化合价升高,被氧化,为还原剂,故B正确;
C.反应中,S元素化合价降低,被还原,SO2为氧化剂,故C错误;
D.S元素化合价不变,不是氧化还原反应,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重于基本概念的理解和运用的考查,为高频考点,注意从元素化合价的角度解答该题,难度不大,注意相关基础知识的积累.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
2.下列说法正确的是( )
| A. | 杂化轨道可以参与π键的形成 | |
| B. | 杂化前后的轨道数不变,但轨道的形状发生了改变 | |
| C. | 共价键都有方向性 | |
| D. | 基态Na原子核外电子占有3个能层、4种能级、6个原子轨道、6种电子运动状态 |
19.设NA为阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 在28g聚乙烯中,含有的碳原子个数为2NA | |
| B. | 在合成28g聚乙烯的单体中,含有NA个碳碳双键 | |
| C. | 在28g聚乙烯中,含有C-H的数目为4NA | |
| D. | 28g聚乙烯完全燃烧时,转移电子数为3NA |
16.将10.7g Mg、Al和Fe组成的合金溶于足量的氢氧化钠溶液中,产生标准状况下4.48L 气体,另取等质量的合金溶于过量盐酸中,生成标准状况下7.84L气体,向反应后的溶液加入过量NaOH溶液,得到沉淀物质的量为( )
| A. | 0.1mol | B. | 0.15mol | C. | 0.25mol | D. | 0.3mol |
3.用下列实验装置进行的实验中,能达到相应实验目的是( )
| A. | 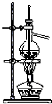 石油的分馏 | B. | 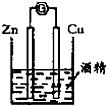 形成原电池 | C. | 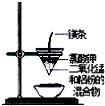 可制得金属锰 | D. | 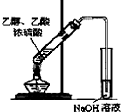 制取乙酸乙酯 |
20.天然维生素P(结构简式如图所示)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述中错误的是( )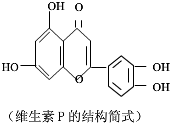

| A. | 可与NaOH溶液反应,1mol该物质可与4mol NaOH反应 | |
| B. | 可与溴水反应,且1mol该物质与足量溴水反应消耗6mol Br2 | |
| C. | 一定条件下1mol该物质可与H2加成,耗H2最大量为7mol | |
| D. | 维生素P遇FeCl3溶液发生显色反应 |
14.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:1,则下列说法中正确的是( )
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 分子中含有氧原子 | D. | 此有机物的最简式为为CH4 |
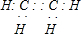 .
.