��Ŀ����
����Ŀ����ϩ�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ����ش�
��1����ϩ�Ľṹʽ�� ��
��2��������ϩ����ͨ��������Ȼ�̼��Һ�У���Ӧ�Ļ�ѧ����ʽΪ ��
��3������������ȥ�����л��е���ϩ���Լ��� �� ������ţ�
��ˮ ������ ����ˮ �����Ը��������Һ
��4����һ�������£���ϩ����ˮ��Ӧ�����л���A��A�Ľṹ��ʽ�� �� �䷴Ӧ��������Ӧ���ȡ�����ӳɡ�����
��5�����л�ѧ��Ӧԭ����ͬ����������ţ���
����ϩʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ
��SO2ʹ��ˮ�����Ը��������Һ��ɫ
��SO2ʹƷ����Һ�͵��з�̪��NaOH��Һ��ɫ��
���𰸡�
��1��![]()
��2��CH2=CH2+Br2��CH2Br��CH2Br
��3����
��4��CH3CH2OH���ӳ�
��5����
���������⣺��1.����ϩ�ĵ���ʽΪ ![]() ����ϩ�ĽṹʽΪ
����ϩ�ĽṹʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��
��2.����ϩ�к���̼̼˫�������ʽϻ��ã��ܺ��巢���ӳɷ�Ӧ����CH2=CH2+Br2��CH2Br��CH2Br�����Դ��ǣ�CH2=CH2+Br2��CH2Br��CH2Br��
��3.����ϩ�к���̼̼˫�������Է����ӳɷ�Ӧ�����Ա�ǿ�����������������鲻�ܣ���ϩ�ܺ���ˮ�����ӳɷ�Ӧ����ϩ�����Ը�����ط�Ӧ���ɶ�����̼���壬��ϩ��ˮ������ֻ����һ�������²ŷ�Ӧ�����Կ���������ȥ�����л��е���ϩ���Լ���������Ȼ�̼��Һ����ѡ�ۣ����Դ��ǣ��ۣ�
��4.����һ�������£���ϩ����ˮ�����ӳɷ�Ӧ�����Ҵ����Ҵ��Ľṹ��ʽΪCH3CH2OH�����Դ��ǣ�CH3CH2OH�� �ӳɣ�
��5.������ϩʹ������Ȼ�̼��Һ��ɫ��ԭ���ǣ������ϩ�����˼ӳɷ�Ӧ����ϩʹ���������Һ��ɫ��ԭ���ǣ���ϩ������ط���������ԭ��Ӧ����ɫ�����Է�Ӧԭ����ͬ���ʴ���SO2ʹ��ˮ�����Ը��������Һ��ɫ��ԭ���ǣ������������ˮ�������ط�Ӧ������ԭ��Ӧ����ɫ�����Է�Ӧԭ����ͬ������ȷ����SO2ʹƷ����Һ��ɫ��ԭ���ǣ������������ɫ������������ɫ���ʶ���ɫ����������ʹ���з�̪��NaOH��Һ��ɫ��ԭ���ǣ�����������������Ʒ�Ӧ�����������ƺ�ˮ��ʹ��Һ�ļ��Խ��Ͷ���ɫ������ԭ����ͬ���ʴ���ѡ�ڣ�

����Ŀ��ij��ɫ��Һ���н������������ӵļ���( ������ˮ�ĵ����Լ����ӵ�ˮ��)��
������ | K+��Al3+��Fe3+��Ba2+��NH4+ |
������ | Cl-��CO32-��HCO3-��SO42- |
ȡ100mL��Һ�ײ��ֳ����ȷݽ�������ʵ��(����ÿ����ȫ��Ӧ):
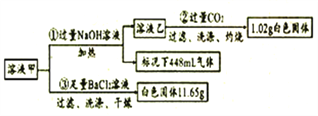
��1���ɢٿ�֪��ԭ��Һ���ڵ�������____��Ũ��Ϊ_____mol/L��
��2��д��ʵ��������ɳ��������ӷ���ʽ_________��
��3��ͨ�����CO2��ַ�Ӧ���轫��Ӧ��Ļ����Һ�����ٹ��ˣ���Ŀ����_______��
��4��ijͬѧͨ��������Ϊ����Һ��һ������K+����������________��
����Ŀ����ҵ�ϳ�����Ļ�����NH3�Ĵ�������ijʵ��С��ʵ�����жԸ÷�Ӧ������̽�����ش���������:
��1�������Ʊ��뾻��
��ʵ���ҳ�����װ�ü��Ʊ����﴿����NH3,����ȡNH3�Ļ�ѧ����ʽ___________________������B��ѡȡ���Լ���______________(����)��

�ڸ�С�����KClO3 MnO2�Ʊ�������O2,ͨ���������ϣ����ָ÷����Ʊ���O2�к���Cl2���ʡ�ͼ���Ǹ�С���Ʊ�����O2ʱ�����õ���װ�á�װ������˳��ΪC![]() ______ (�����������ظ�ʹ��)�����г�ȥCl��Ӧ�Ļ�ѧ����ʽΪ_________��
______ (�����������ظ�ʹ��)�����г�ȥCl��Ӧ�Ļ�ѧ����ʽΪ_________��
��2�����Ĵ�����
��ͼ�л���h�ͻ���i,��(1)���Ʊ��Ĵ���NH3��O2 (O2����) ͨ�뵽Fװ���У���Ƽ��ȣ��۲�����
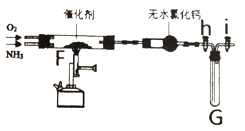
�������� | ʵ������ | ����ԭ�� |
������Ϊ����״̬��ֹͣ���� | ���۳������ȣ�G�Թ��ڢ� _____________ | ��__________ |
�رջ���h�ͻ���i��ȡ��װ�� G,����װ��������ˮ�� | G���Թ��ڢ�__________ | ��__________ |


