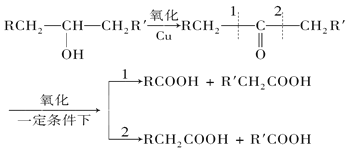
题目内容
【题目】开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g)+ H2O(g)![]() CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是__________________。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)![]() CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应己经达到平衡状态的是_________________。
CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应己经达到平衡状态的是_________________。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25°C时,在20mL0.lmol/L 氢氟酸中加入VmL0.lmol/LNaOH 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9. 9×10-7mol/L
C.②点时,溶液中的c(F- )=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0. lmol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,该反应的化学方程式为___________________。
【答案】 CO(g) + H2O(g)![]() CO2(g)+ H2(g) △H=-41.2 kJ·mol-1 cd BC H2O+HFO=HF+H2O2
CO2(g)+ H2(g) △H=-41.2 kJ·mol-1 cd BC H2O+HFO=HF+H2O2
【解析】本题考查热化学反应方程式的书写、化学平衡状态的判断、离子浓度大小比较,(1)①CH4(g)+ H2O(g) ![]() CO(g)+3H2(g),②CH4(g)+2H2O(g)
CO(g)+3H2(g),②CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),CO和水蒸气反应方程式为CO+H2O=CO2+H2,②-①得出:CO(g)+H2O(g)=CO2(g)+H2(g) △H=(165.0-206.2)kJ·mol-1=-41.2kJ·mol-1;(2)a、组分都是气体,则气体质量不变,容器为恒容状态,则气体V不变,根据密度的定义,密度任何一时刻都相等,即密度不变不能作为达到平衡的标志,故a错误;b、消耗甲烷,生成氢气,化学反应向正反应方向进行,不能说明反应达到平衡,故b错误;c、反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡,故c正确;d、v正(CH4)说明反应向正反应进行,v逆(H2)说明反应向逆反应进行,且两者速率之比等于化学计量数之比,因此能说明反应达到平衡,故d正确;(3)A、pH=3的HF溶液中c(OH-)=10-11mol·L-1,HF为弱酸,OH-是由水电离产生,因此HF溶液中水电离出c(H+)=10-11,NaF属于强碱弱酸盐,F-发生水解,结合水电离出H+,因此NaF溶液中水电离出c(OH-)=10-3mol·L-1,即水电离出c(H+)=10-3mol·L-1,因此两种溶液中水电离出c(H+)不同,故A错误;B、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),得出c(F-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7mol·L-1,故B正确;C、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),②点pH=7,即c(H+)=c(OH-),得出c(Na+)=c(F-),故C正确;D、混合后,n(Na+)=20×10-3×0.1mol=2×10-3mol,混合后c(Na+)=2×10-3/(20+20)×10-3mol·L-1=0.05mol·L-1,故D错误;(4)根据信息,推出HFO+H2O→HF+A,HFO中H显+1价,O显0价,F显-1价,根据元素守恒,推出A为H2O2,即化学反应方程式为HFO+H2O=HF+H2O2。
CO2(g)+4H2(g),CO和水蒸气反应方程式为CO+H2O=CO2+H2,②-①得出:CO(g)+H2O(g)=CO2(g)+H2(g) △H=(165.0-206.2)kJ·mol-1=-41.2kJ·mol-1;(2)a、组分都是气体,则气体质量不变,容器为恒容状态,则气体V不变,根据密度的定义,密度任何一时刻都相等,即密度不变不能作为达到平衡的标志,故a错误;b、消耗甲烷,生成氢气,化学反应向正反应方向进行,不能说明反应达到平衡,故b错误;c、反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡,故c正确;d、v正(CH4)说明反应向正反应进行,v逆(H2)说明反应向逆反应进行,且两者速率之比等于化学计量数之比,因此能说明反应达到平衡,故d正确;(3)A、pH=3的HF溶液中c(OH-)=10-11mol·L-1,HF为弱酸,OH-是由水电离产生,因此HF溶液中水电离出c(H+)=10-11,NaF属于强碱弱酸盐,F-发生水解,结合水电离出H+,因此NaF溶液中水电离出c(OH-)=10-3mol·L-1,即水电离出c(H+)=10-3mol·L-1,因此两种溶液中水电离出c(H+)不同,故A错误;B、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),得出c(F-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7mol·L-1,故B正确;C、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),②点pH=7,即c(H+)=c(OH-),得出c(Na+)=c(F-),故C正确;D、混合后,n(Na+)=20×10-3×0.1mol=2×10-3mol,混合后c(Na+)=2×10-3/(20+20)×10-3mol·L-1=0.05mol·L-1,故D错误;(4)根据信息,推出HFO+H2O→HF+A,HFO中H显+1价,O显0价,F显-1价,根据元素守恒,推出A为H2O2,即化学反应方程式为HFO+H2O=HF+H2O2。

 阅读快车系列答案
阅读快车系列答案【题目】某无色溶液甲中仅含有下列离子的几种( 不考虑水的电离以及离子的水解);
阳离子 | K+、Al3+、Fe3+、Ba2+、NH4+ |
阴离子 | Cl-、CO32-、HCO3-、SO42- |
取100mL溶液甲并分成两等份进行如下实验(假设每步完全反应):
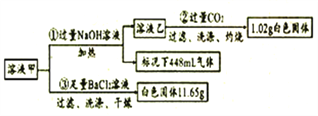
(1)由①可知,原溶液存在的离子有____,浓度为_____mol/L。
(2)写出实验②中生成沉淀的离子方程式_________。
(3)通入过量CO2充分反应后,需将反应后的混合溶液加热再过滤,其目的是_______。
(4)某同学通过分析认为该溶液中一定存在K+,其理由是________。