题目内容
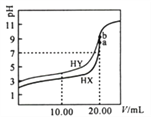
【题目】某同学用密度为1.84g/cm3、质量分数为 98%的浓硫酸配制500mL0.22 mol/L的稀硫酸。
(1)操作过程中使用到的玻璃仪器有_____________________________________________________;
(2)实验过程中涉及的操作如下:
①将容量瓶中的溶液倒入试剂瓶中并贴上标签;
②将浓硫酸沿烧杯内壁缓慢注入盛有约160mL蒸馏水的烧杯中并小心搅拌;
③用规格为 的量筒量取 mL的浓硫酸;
④将已冷却的硫酸溶液转移到容量瓶中,并用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液全部转移到容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
⑤改用胶头滴管滴加蒸馏水,使溶液凹液面最低处恰好与刻度线相切;
⑥塞好玻璃塞,反复颠倒摇匀;
⑦继续向容量瓶中加蒸馏水直到距离刻度线 处;
将步骤③、⑦补充完整:_____________,_____________,_______________;
实验操作顺序为__________________________________________(填序号)。
(3)配制该溶液的过程中,下列操作使得所配得的溶液浓度偏小的是______________(填字母) 。
A.稀释密度为1.84g/cm3、质量分数为 98%的浓硫酸时,不小心溅出少量硫酸溶液
B.用蒸馏水洗涤烧杯、量筒及玻璃棒,并将洗涤液注入容量瓶中
C.定容时反复上下倒转容量瓶后,发现凹液面最低处低于刻度线,再补加水到刻度线
D.量取密度为1.84g/cm3、质量分数为 98%的浓硫酸时,仰视量筒的刻度线
E.洗涤容量瓶后,立即用来配制溶液
F.稀释浓硫酸结束后立即将溶液转移到容量瓶中
【答案】500mL容量瓶、量筒、玻璃棒、烧杯、胶头滴管 10mL 6.0 1~2cm ③②④⑦⑤⑥① AC
【解析】
(1)依据配制一定物质的量浓度溶液的基本步骤有:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,根据各步骤判断用到的仪器;
(2)依据c=![]() 计算浓硫酸的物质的量浓度,依据稀释前后溶液含溶质的物质的量不变计算需要浓硫酸的体积;
计算浓硫酸的物质的量浓度,依据稀释前后溶液含溶质的物质的量不变计算需要浓硫酸的体积;
(3)依据c=![]() ,分析不当操作对溶质的物质的量和溶液的体积的影响,进行误差的分析判断。
,分析不当操作对溶质的物质的量和溶液的体积的影响,进行误差的分析判断。
(1)配制一定物质的量浓度溶液的步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,用到的仪器有:量筒、玻璃棒、烧杯、500mL容器瓶、胶头滴管,故答案为:量筒、玻璃棒、烧杯、500mL容器瓶、胶头滴管;
(2)③密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度c= ![]() =18.4mol/L,稀释前后溶液含溶质的物质的量不变,设需要浓硫酸体积为V,则V×18.4mol/L=500mL×0.22mol/L,解得V=6.0mL,所以应选择10mL量筒;故答案为:10mL;6.0;
=18.4mol/L,稀释前后溶液含溶质的物质的量不变,设需要浓硫酸体积为V,则V×18.4mol/L=500mL×0.22mol/L,解得V=6.0mL,所以应选择10mL量筒;故答案为:10mL;6.0;
⑦定容时,开始继续向容量瓶中加蒸馏水直到距离刻度线1-2cm,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切,故答案为:1~2;
配制一定物质的量浓度溶液的步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的操作顺序为:③②④⑦⑤⑥①,故答案为:③②④⑦⑤⑥①;
(3)A.稀释密度为1.84g/cm3、质量分数为98%的浓硫酸时,不小心溅出少量硫酸溶液,导致溶质的物质的量偏小,溶液的浓度偏小,故A正确;B.用蒸馏水洗涤烧杯、量筒及玻璃棒,并将洗涤液注入容量瓶中,是正确的操作,对结果无影响,故B错误;C.定容时反复上下倒转容量瓶后,发现凹液面最低处低于刻度线,再补加水到刻度线,导致溶液体积偏大,浓度偏小,故C正确;D.量取密度为1.84g/cm3、质量分数为98%的浓硫酸时,仰视量筒的刻度线,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液的浓度偏大,故D错误;E.洗涤容量瓶后,立即用来配制溶液,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故E错误;F.稀释浓硫酸结束后,未冷却立即将溶液转移到容量瓶中,导致溶液的体积偏小,浓度偏大,故F错误;故答案为:AC。

 怎样学好牛津英语系列答案
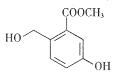
怎样学好牛津英语系列答案【题目】I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写为![]() .有机物X的键线式为:
.有机物X的键线式为: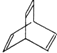
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式_______________;
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式_______________________;
(3)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它们的对应二甲苯的熔点分别为:
一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
由以上数据推断:
熔点为234℃的一溴代二甲苯的结构简式为____________;熔点为-27℃的二甲苯的名称为____________;
II.治疗甲型H1N1流感的常见药物有奥司他韦、扎那米韦、金刚乙胺及金刚烷胺以及预防药物如中药材金银花、大青叶等。其中金刚烷胺可按下列路线合成:

已知狄尔斯阿德耳反应(也称双烯合成反应)如下所示:

试回答下列问题:
(1)B的结构式为________________(填键线式)。
(2)上述物质中,属于同分异构体的是________(填字母)。
(3)上述反应中,属于加成反应的是________(填数字)。
【题目】已知:![]()
利用如图装置用正丁醇合成正丁醛![]() 相关数据如表:
相关数据如表:
物质 | 沸点 | 密度 | 水中溶解性 |
正丁醇 |
|
| 微溶 |
正丁醛 |
|
| 微溶 |
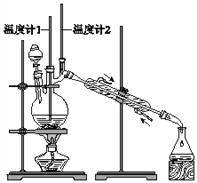
下列说法中,不正确的是![]()
A. 为防止产物进一步氧化,应将酸化的![]() 溶液逐滴加入正丁醇中
溶液逐滴加入正丁醇中
B. 当温度计1示数为![]() ,温度计2示数在
,温度计2示数在![]() 左右时,收集产物
左右时,收集产物
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 向获得的粗正丁醛中加入氢氧化钠后再蒸馏,可进一步除去粗产品中的正丁醇杂质