题目内容
根据可逆反应: +2I-+2H+
+2I-+2H+
 +I2+H2O,设计如下图所示实验装置。B烧杯中装有Na3AsO4和Na3AsO3溶液,A烧杯中装有I2和KI溶液。两烧杯中用一倒置的装有饱和KI溶液的U型管相连,该装置称为盐桥,其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因相连通而导电。C1、C2棒为惰性电极。进行如下操作:
+I2+H2O,设计如下图所示实验装置。B烧杯中装有Na3AsO4和Na3AsO3溶液,A烧杯中装有I2和KI溶液。两烧杯中用一倒置的装有饱和KI溶液的U型管相连,该装置称为盐桥,其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因相连通而导电。C1、C2棒为惰性电极。进行如下操作:
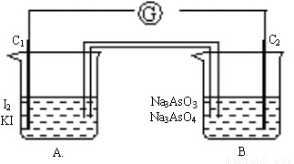
①向A溶液中逐滴加入浓HCl,发现电流计指针发生偏转;
②若改向B溶液中滴加40%的 NaOH溶液,发现电流计指针向相反方向偏转。
试回答以下问题:
(1)两次操作中,可以观察到电流计指针偏转方向相反,为什么?试用化学平衡原理解释之 ;
(2)操作①过程中,C1棒上发生的电极反应式为: ,操作②过程中C2棒上发生的电极反应式为: 。
(1)操作①使平衡正向移动,C1作负极;操作②使平衡逆向移动,C2作负极。故两次电流方向相反(答案合理即可给分)。
(2)2I- — 2e- = I2 ; AsO33- + 2 OH- — 2e- = AsO43- + H2O 。
【解析】
试题分析:由图可知,该装置为原电池,(Ⅰ)发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,电极反应发生2I--2e-=I2;
(Ⅱ)发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,
(1)因两次操作过程均能形成原电池,都是把化学能转化为电能,形成电流指针偏转,)但是操作①使平衡正向移动,C1作负极;操作②使平衡逆向移动,C2作负极。故两次电流方向相反
(2)操作①过程中,C1棒为负极,电极反应发生2I--2e-=I2;
操作②过程中C2棒为负极,电极反应为AsO33- + 2 OH- — 2e- = AsO43- + H2O
考点:考查电解池和原电池