题目内容
用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
| A.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA |
| B.50mL18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA |
| C.一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA |
| D.电解1L NaCl溶液至c(OH-) =" 0.2" mol·L -1,转移电子数为0.4NA(假设电解过程中溶液体积不变) |
C
解析试题分析:A发生可逆反应N2+3 H2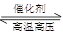 2NH3不能进行到底,所以转移电子的个数小于0.6NA。错误。
2NH3不能进行到底,所以转移电子的个数小于0.6NA。错误。
B.发生反应:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。n(H2SO4)=" 0.05L×18.4" mol/L=0.92mol由于Cu足量,所以产生的气体应该按照硫酸来确定。随着反应的进行,硫酸变稀,反应就不再进行。所以发生反应的硫酸的物质的量小于0.92mol。因此生成SO2的分子数小于0.46NA。错误。C.n(Na)="m/M=" 2.6g÷23g/mol=0.2mol,无论反应条件如何,也无论产物是什么,Na是正一价的金属,所以转移电子0.2mol,即失去的电子数为0.2NA。正确。D.在电解NaCl溶液的过程中,n(OH-)=C·V=0.2mol,则转移电子0.2mol,也就是0.2NA。因此该选项错误。
CuSO4+SO2↑+2H2O。n(H2SO4)=" 0.05L×18.4" mol/L=0.92mol由于Cu足量,所以产生的气体应该按照硫酸来确定。随着反应的进行,硫酸变稀,反应就不再进行。所以发生反应的硫酸的物质的量小于0.92mol。因此生成SO2的分子数小于0.46NA。错误。C.n(Na)="m/M=" 2.6g÷23g/mol=0.2mol,无论反应条件如何,也无论产物是什么,Na是正一价的金属,所以转移电子0.2mol,即失去的电子数为0.2NA。正确。D.在电解NaCl溶液的过程中,n(OH-)=C·V=0.2mol,则转移电子0.2mol,也就是0.2NA。因此该选项错误。
考点:考查阿伏加德罗常数在化学反应的计算中的应用的知识。

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
| B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| C.12 g石墨和C60的混合物中质子总数一定为6NA个 |
| D.常温常压下,22.4L乙烯中C?H键数为4NA |
下列化学用语的表述正确的是
A.离子结构示意图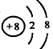 :可以表示16O2-,也可以表示18O2- :可以表示16O2-,也可以表示18O2- |
B.比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 |
C.氯化铵的电子式为: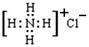 |
D.CO2的结构式为: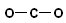 |
下列有关化学用语表述正确的是
A.质量数为16的氧原子: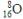 |
| B.漂白粉的有效成分:NaClO |
C.Mg2+结构示意图: 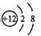 |
D.钠在氧气中燃烧的化学方程式:4Na+O2  2Na2O 2Na2O |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A.28g氮气所含有的原子数目为NA |
| B.化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
| C.标准状况下,22.4L水中含有NA个水分子 |
| D.标准状况下,22.4L氯化氢所含的原子数为NA |
用NA表示阿佛加德罗常数,下列叙述中正确的是
| A.常温常压下,22.4 L的氧气含氧原子数为2NA |
| B.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| C.常温下,23g NO2含有NA个氧原子 |
| D.足量铜与1L 18mol·L-1浓硫酸反应可以得到SO2的分子总数为9NA |
下列化学用语正确的是
A.中子数为20的氯原子: |
| B.硫酸的电离方程式:H2SO4=H2++SO42— |
| C.漂白粉的有效成分:CaCl2 |
| D.明矾的化学式:KAl(SO4)2?12H2O |
有关四氯化碳的化学用语正确的是
A.结构简式: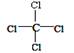 | B.电子式: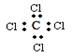 |
| C.结构简式:CCl4 | D.比例模型:  |