题目内容
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A.28g氮气所含有的原子数目为NA |
| B.化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
| C.标准状况下,22.4L水中含有NA个水分子 |
| D.标准状况下,22.4L氯化氢所含的原子数为NA |
B
解析试题分析:A.n(N2)=m/M=28g÷28g/mol=1mol.,所以N(N2)=NA,N(N)="2" NA.错误。B.Mg是+2价的金属,每mol的Mg参加反应转移电子的物质的量为2mol,。即化学反应中1mol金属镁变成镁离子时失去电子数目为2NA。正确。C. 标准状况下,水不是气体,不能使用气体摩尔体积。错误。D.HCl为双原子分子,每个分子中含有2个原子。标准状况下,22.4L氯化氢的物质的量为1mol,所以所含有的原子数为2NA。错误。
考点:考查阿伏加德罗常数的有关计算的知识。

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
据某权威刊物报道,科学家在宇宙中发现了H3分子,对于相同物质的量的H3和H2,下列各项中一定相等的是( )
| A.质量 | B.体积 | C.分子数 | D.原子数 |
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl— 的物质的量之比为
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.3∶4∶3 |
设NA表示阿伏加德罗常数的数值,则下列说法中正确的是
| A.常温常压下,8.0g CH4中含有的氢原子数为2 NA |
| B.1 mol氯气跟水完全反应,转移的电子数为2 NA |
| C.1 mol Na2O2含离子数为4NA |
| D.0.1 mol/L MgCl2溶液中含氯离子数为0.2 NA |
用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
| A.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA |
| B.50mL18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA |
| C.一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA |
| D.电解1L NaCl溶液至c(OH-) =" 0.2" mol·L -1,转移电子数为0.4NA(假设电解过程中溶液体积不变) |
下列叙述中正确的是( )
| A.1 mol H2O的质量是18g/mol | B.硫酸根离子的摩尔质量是96g |
| C.CO2的摩尔质量是44g/mol | D.HCl的相对分子质量是36.5g/mol |
相同条件下,质量相同的NH3和CH4,下列说法正确的是
| A.密度比为16:17 | B.氢原子比为3:4 |
| C.物质的量比为1:1 | D.体积比为16:17 |
某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.1%,300mL该溶液中氯离子的物质的量为
| A.0.37mol | B.0.63mol | C.0.74mol | D.1.5mol |
设NA为阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4 L甲苯中含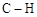 键数目为8 NA 键数目为8 NA |
| B.常温常压下,7.8 g苯中含有双键的数目为0.3 NA |
| C.苯和苯甲酸的混合物1 mol,完全燃烧消耗O2的分子数为7.5 NA |
| D.常温常压下,5.2 g苯和苯乙烯的混合物中含有原子数目为0.8 NA |