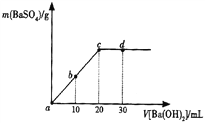
题目内容
【题目】Ⅰ. 在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示2 min内的平均反应速率为________,A的转化率为________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度________(填“增大”、“减
少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加
入______ mol B物质。
(4)若向原平衡体系中再投入1 mol A和1 mol B,平衡________(填“右移”、“左移”或“不
移动”)。
Ⅱ.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则 :
①每消耗1 mol CH4可以向外电路提供____ mol e-;
②负极电极反应式为__________________________________________;
③电池放电后,溶液的pH不断________。
【答案】 0.2 mol·L-1·min-1 60% 增大 4/3 右移 8 CH4+10OH--8e-=CO![]() +7H2O 减小
+7H2O 减小
【解析】(Ⅰ)(1)V(D)=c/t=0.8mol÷2L÷2min=0.2 mol·L-1·min-1;
根据化学方程式:3A(g)+B(g) ![]() 2C(g)+2D(g)
2C(g)+2D(g)
初始物质的量(mol) 2 2 0 0
转化物质的量(mol)1.2 0.4 0.8 0.8
平衡物质的量(mol)0.8 1.6 0.8 0.8
则A的转化率=1.2mol÷2mol×100%=60%。
(2)反应混合物都为气体,总质量不变,体积减小,平衡体系中混合气体的密度增大。
(3)平衡时各物质的质量分数与原平衡相等,为等效平衡,应前后气体体积不变,按化学计量数转化到左边,满足n(A):n(B)=1:1即可。根据
3A(g)+B(g)![]() 2C(g)+2D(g)可知,C和D各4/3mol,转化到左边可得A为2mol,B为2/3mol。令B的物质的量为nmol,则:2mol:(n+2/3)mol=2mol:2mol,解得n=4/3。
2C(g)+2D(g)可知,C和D各4/3mol,转化到左边可得A为2mol,B为2/3mol。令B的物质的量为nmol,则:2mol:(n+2/3)mol=2mol:2mol,解得n=4/3。
(4)增大反应物的浓度,平衡向正反应方向移动。
(Ⅱ)(1)CH4完全燃烧生成二氧化碳,碳元素由-4价转化为+4价,则每消耗1 mol CH4可以向外电路提供8 mol e-;②生成的二氧化碳在碱性介质中生成碳酸酸离子,半反应为:CH4+10OH--8e-=CO![]() +7H2O;③电池放电后,由半反应可知溶液的pH不断下降。
+7H2O;③电池放电后,由半反应可知溶液的pH不断下降。

 53随堂测系列答案
53随堂测系列答案【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。
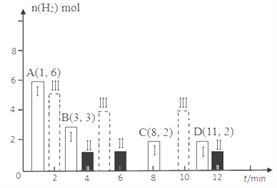
①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂