题目内容
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O ( l ) ΔH=-57.3 kJ / mol
分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时反应热分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是
分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时反应热分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是
| A.ΔH1>ΔH3>ΔH2 | B.ΔH1<ΔH2<ΔH3 |
| C.ΔH1=ΔH2=ΔH3 | D.ΔH1<ΔH3<ΔH2 |
A
试题分析:①稀醋酸是弱电解质电离需要吸收热量,因此反应热小于57.3 kJ / mol;②浓硫酸溶于水会放出热量,因此与NaOH反应时放出的热量大于57.3 kJ / mol;③稀硝酸在水中完全电离,产生的H+与OH-发生中和反应放出的热量等于57.3 kJ / mol。因此它们的关系正确的是ΔH1>ΔH3>ΔH2。选项为A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol

 时间/min
时间/min
 Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g

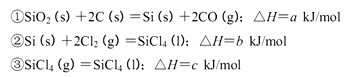
 2H2(g)+O2(g) ΔH1
2H2(g)+O2(g) ΔH1