题目内容
1.在常温常压下,取下列等质量4种气态烃,分别在足量的氧气中燃烧,其中消耗氧气最多的是( )| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
分析 CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O可知,相同质量烃燃烧耗氧量规律为:氢的质量分数越大,完全燃烧耗氧越多,即$\frac{y}{x}$越大,耗氧量越大,以此来解答.
解答 解:氢的质量分数越大,完全燃烧耗氧越多,
A.甲烷CH4,H原子与C原子个数比为4:1;
B.乙烷炔C2H6,H原子与C原子个数比为6:2=3:1;
C.丙烷C3H8,H原子与C原子个数比为8:3;
D.丁烷C4H10,H原子与C原子个数比为5:2;
所以H原子与C原子个数比关系为:CH4>C2H6>C3H8>C4H10,
所以相同质量的各烃中甲烷的燃烧耗氧量最大,
故选A.
点评 本题考查化学反应方程式的计算,为高频考点,把握有机物的燃烧反应及规律为解答的关键,侧重分析与计算能力的考查,注意$\frac{y}{x}$越大耗氧量越大,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列各项不属于官能团的是( )
| A. | NO3- | B. | -NO2 | C. | -OH | D. | 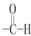 |
9.下列有机化合物分子中的所有碳原子不可能处于同一平面的是( )
| A. | HC≡C-CH3 | B. | 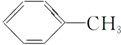 | C. | 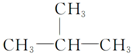 | D. | 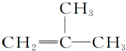 |
16.YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,关于${\;}_{39}^{89}$Y的说法正确的是( )
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 | |
| D. | 中子数为39 |
6.根据CH2=CHCH2COOH的结构,它不可能发生的反应是( )
| A. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与银氨溶液反应析出银 | |
| D. | 与新制氢氧化铜反应 |
13.表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与浓度相等的稀盐酸反应的速率为Q>L |
10.下列叙述中,正确的是( )
| A. | 不同的原子之间只能构成共价化合物 | |
| B. | 单质中不一定存在非极性键 | |
| C. | 非金属原子之间只能构成共价化合物 | |
| D. | Cl2的沸点比F2高,这与化学建的大小有关 |
 .
.