题目内容
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大.元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子.
(1)F+离子的电子排布式是 .
(2)B、C、D元素的第一电离能由大到小的顺序是 .
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是;B、C的这些氢化物的沸点相差较大的主要原因是 .
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是;1mol该分子中含有π键的数目是 .
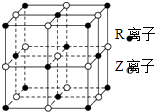
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 , C原子的配位数是 . 
【答案】
(1)1s22s22p63s23p63d10{或[Ar]3d10}
(2)N>O>C
(3)C2H6;氮的氢化物(N2H4)分子间存在氢键
(4)sp2;1mol
(5)Cu3N;6
【解析】解:A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大;元素A是原子半径最小的元素,则A是H元素;B元素基态原子的核外电子分占四个原子轨道(能级),则B为C元素;D元素原子的已成对电子总数是未成对电子总数的3倍,则D是O元素,C元素原子序数大于B而小于D,则C是N元素;E与D处于同一主族,则E是S元素;F位于ds区,且原子的最外层只有1个电子,则F为Cu元素;(1)Cu+是Cu原子失去最外层电子得到的离子,其离子核外有28个电子,根据构造原理书写亚铜离子核外电子排布式为1s22s22p63s23p63d10{或[Ar]3d10},故答案为:1s22s22p63s23p63d10{或[Ar]3d10};(2)B、C、D分别是C、N、O元素,且位于同一周期,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C,故答案为:N>O>C;(3)C、N元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物为C2H6;
含有氢键的氢化物熔沸点较高,氮的氢化物中含有氢键而碳的氢化物中不含氢键,所以氮的氢化物熔沸点较高,
故答案为:C2H6;氮的氢化物(N2H4)分子间存在氢键;(4)H、C、O可形成分子式为H2CO的某化合物,为HCHO,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp2;一个甲醛分子中含有1个π键,则1mol甲醛中含有1molπ键,
故答案为:sp2;1mol;(5)N、Cu两元素形成的某化合物的晶胞结构如图所示,该晶胞中Cu原子个数=12× ![]() =3、N原子个数=8×
=3、N原子个数=8× ![]() =1,所以其化学式为Cu3N;该晶胞中N原子配位数为6,
=1,所以其化学式为Cu3N;该晶胞中N原子配位数为6,
故答案为:Cu3N;6.
A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大;元素A是原子半径最小的元素,则A是H元素;B元素基态原子的核外电子分占四个原子轨道(能级),则B为C元素;D元素原子的已成对电子总数是未成对电子总数的3倍,则D是O元素,C元素原子序数大于B而小于D,则C是N元素;E与D处于同一主族,则E是S元素;F位于ds区,且原子的最外层只有1个电子,则F为Cu元素;(1)Cu+是Cu原子失去最外层电子得到的离子,其离子核外有28个电子,根据构造原理书写亚铜离子核外电子排布式;(2)B、C、D分别是C、N、O元素,且位于同一周期,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;(3)C、N元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物为乙烷;
含有氢键的氢化物熔沸点较高;(4)H、C、O可形成分子式为H2CO的某化合物,为HCHO,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式;一个甲醛分子中含有1个π键;(5)N、Cu两元素形成的某化合物的晶胞结构如图所示,利用均摊分计算该晶胞中N、Cu原子个数,从而确定其化学式;该晶胞中N原子配位数为6.