题目内容
【题目】如图是中学化学中常用于混合物的分离和提纯的装置。
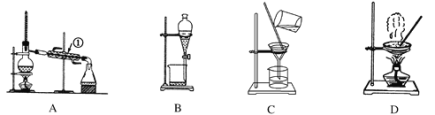
利用以上装置,可以按以下实验方案从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。(已知甲苯和甲醇均为有机溶剂,有机物大多能互溶)

(1)装置A中仪器①的作用是________,使用装置A的操作是_____(填“a”、“b”、“c”或“d”,下同)。
(2)使用装置B的操作是______,为使其中液体顺利滴下,除打开下端活塞外,还应进行的具体操作是___________________。
(3)使用装置C的操作是_______,若所得沉淀不溶于水且需要洗涤,则洗涤的具体操作是________________________________________________________________________________。
(4)使用装置D的操作是_______。
【答案】冷凝db将分液漏斗上部的玻璃塞打开a往漏斗中加水至没过沉淀,让水自然流干,重复加水2-3次c
【解析】
操作a是分离固液混合物,其操作为过滤,操作b是分离互不相溶的液体混合物,需进行分液,要用到分液漏斗;操作c是从溶液中得到固体,操作为蒸发,需要蒸发皿;操作d是从有机化合物中,利用沸点不同采取蒸馏得到甲苯。据此解答。
(1)装置A中仪器①是冷凝管,其作用是冷凝。装置A是蒸馏装置,根据以上分析可知使用装置A的操作是d。
(2)装置B是分液,根据以上分析可知使用装置B的操作是b。为使其中液体顺利滴下,需要保持内外压强相等,因此除打开下端活塞外,还应进行的具体操作是将分液漏斗上部的玻璃塞打开。
(3)装置C是过滤,根据以上分析可知使用装置C的操作是a。若所得沉淀不溶于水且需要洗涤,洗涤时应该在过滤器中进行,则洗涤的具体操作是往漏斗中加水至没过沉淀,让水自然流干,重复加水2~3次。
(4)装置D是蒸发,则根据以上分析可知使用装置D的操作是c。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案