题目内容
12.下列说法正确的是( )| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 两种物质反应,无论方程式的书写形式如何,平衡常数均不变 | |
| D. | 增大反应物浓度,使活化分子百分数增加,化学反应速率增大 |
分析 A、根据△G=△H-T•△S判断;
B、该反应为吸热反应,不能自发进行;而最终该反应能自发进行,则主要原因是体系有自发地向混乱度增加的方向转变的倾向;
C、平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
D、增大反应物的浓度,活化分子的百分数不变;
解答 解:A、根据△G=△H-T•△S判断,对于△H<0、△S>0的反应在温度低时,如△G<0,反应能自发进行,故A错误;
B、该反应为吸热反应,不能自发进行;而最终该反应能自发进行,则主要原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C、温度一定,同一反应化学计量数不同,平衡常数不同,故C错误;
D、增大反应物的浓度,活化分子的浓度增大,但活化分子的百分数不变,故D错误;
故选B.
点评 本题考查焓变和熵变,题目难度不大,注意反应能否自发进行取决于焓变和熵变的综合判据,当△G=△H-T•△S<0,能自发进行.

练习册系列答案
相关题目
15.碳酸铰[(NH4)2CO3]在室温下就能自发地分解产生氨气,下列说法正确的是( )
| A. | 碳酸盐都不稳定,都能自发分解 | |
| B. | 碳酸铰分解是因为进行了加热的操作 | |
| C. | 碳酸铰分解是吸热反应,此反应不应该自发进行,必须借助外力才能进行 | |
| D. | 碳酸铰分解是因为生成了易挥发的气体,使体系的熵增大 |
20.下列说法或表示法正确的是( )
| A. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ•mol-1 | |
| B. | 已知C(石墨)→C(金刚石)△H=+119kJ•mol-1,则相同条件下等质量的石墨、金刚石分别完全燃烧,石墨放出的能量比金刚石的高 | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3kJ | |
| D. | 已知25℃、101 kPa条件下:4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9 kJ/mol;4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1kJ/mol,等质量的O2比O3能量低,由O2变O3为放热反应 |
17.自2013年3月我国北方地区出现了雾霾天气,其产生的原因说法不一,汽车的尾气排放被称为原因之一,有关氮的化合物的研究是一项重要课题.
(1).已知N2(g)+O2(g)=2NO(g)△H=+180.5KJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ•mol-1
则加催化剂处理汽车尾气的热化学方程是2CO(g)+2NO(g)=2CO2(g)+N2(g)△H=-746.5KJ•mol-1
(2).反应2NO2(g)?2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
①条件A与条件B表示的是该反应在某不同条件的反应状况,该不同条件是B
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是ACE
A.V正(NO2)=V逆(NO)
B.c(NO2)=c(NO)
C.O2的物质的量不变
D.混合气体的密度不变
E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为0.0015mol•L-1•s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应正向(填“正向”、“逆向”或“不移动”).
(1).已知N2(g)+O2(g)=2NO(g)△H=+180.5KJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ•mol-1
则加催化剂处理汽车尾气的热化学方程是2CO(g)+2NO(g)=2CO2(g)+N2(g)△H=-746.5KJ•mol-1
(2).反应2NO2(g)?2NO(g)+O2(g) 在容积为2.0L的密闭容器中进行,反应过程中NO2的物质的量随时间的变化如下表
| 时间(s) | 0 | 10 | 20 | 25 | 30 |
| 条件A[n(NO2)](mol) | 0.20 | 0.14 | 0.13 | 0.13 | 0.13 |
| 条件B[n(NO2)](mol) | 0.20 | 0.10 | 0.10 | 0.10 | 0.10 |
A.有、无催化剂 B.温度不同 C.压强不同 D.容器体积不同
②能说明该反应已达到平衡状态的是ACE
A.V正(NO2)=V逆(NO)
B.c(NO2)=c(NO)
C.O2的物质的量不变
D.混合气体的密度不变
E.混合气体的平均摩尔质量
③在条件A从反应开始至10s时,氧气的平均速率为0.0015mol•L-1•s-1
④在条件B不变保持压强不变的条件下,向平衡体系里再通入0.15molO2和0.1molNO2,则反应正向(填“正向”、“逆向”或“不移动”).
1.下列各表述与示意图一致的是( )
| A. | 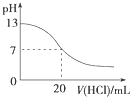 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 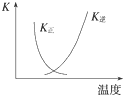 图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. |  图表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 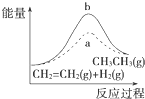 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)-→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
2.卤代烃(CH3)2C═CHCl能发生的反应有( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色
⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦加聚反应.
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色
⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦加聚反应.
| A. | 以上反应均可发生 | B. | 只有③⑥不能发生 | ||
| C. | 只有①⑦不能发生 | D. | 只有②⑥不能发生 |
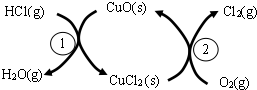 (1)盖斯定律在生产和科学研究中有很重要的意义.
(1)盖斯定律在生产和科学研究中有很重要的意义.