题目内容
(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
针对甲、乙、丙三组实验,回答下列问题:
①甲组反应后,溶液中离子浓度的大小顺序为__________________;
②乙组b 7(填“>”、“<”或“=”)
③丙组溶液混合后c=7,A 0.1mol·L-1(填“>”、“<”或“=”)
④甲中a=6,混合溶液中c(Cl-)-c(NH4+)= ____________mol·L-1 (列式表示结果,不能做近似计算)。(2)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH 的变化关系如右图所示。
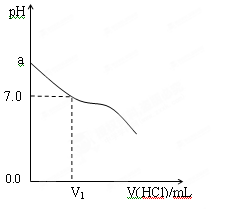
①a >7.0的理由是(用离子方程式表示) 。
②当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka (设混合后的体积为二者的体积之和,计算结果保留两位有效数字。)
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
针对甲、乙、丙三组实验,回答下列问题:
①甲组反应后,溶液中离子浓度的大小顺序为__________________;
②乙组b 7(填“>”、“<”或“=”)
③丙组溶液混合后c=7,A 0.1mol·L-1(填“>”、“<”或“=”)
④甲中a=6,混合溶液中c(Cl-)-c(NH4+)= ____________mol·L-1 (列式表示结果,不能做近似计算)。(2)常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的PH 的变化关系如右图所示。

①a >7.0的理由是(用离子方程式表示) 。
②当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COOH的电离平衡常数Ka (设混合后的体积为二者的体积之和,计算结果保留两位有效数字。)
(1)c(Cl-)>c(NH4+)>c(H+)>c(OH-)(2分);>(2分);>(2分);10-6-10-8(2分)
(2)CH3COO-+H2O CH3COOH+OH-(2分);1.7×10-5(3分)
CH3COOH+OH-(2分);1.7×10-5(3分)
(2)CH3COO-+H2O
 CH3COOH+OH-(2分);1.7×10-5(3分)
CH3COOH+OH-(2分);1.7×10-5(3分)试题分析:(1)①甲组实验中氨水和盐酸的浓度、体积相同,二者恰好反应生成氯化铵。由于NH4+水解溶液显酸性,因此溶液中离子浓度大小关系是c(Cl-)>c(NH4+)>c(H+)>c(OH-)。
②盐酸是强酸,氨水是弱碱。因此pH=12的氨水浓度大于0.01mol/L,所以在体积相等的条件下二者反应氨水过量,溶液显碱性,因此溶液的pH>7。
③丙组溶液混合后c=7,这说明氨水和盐酸反应后溶液显中性。由于二者恰好反应时,溶液显酸性。因此要使反应后的溶液显中性,则氨水要过量,所以强酸的浓度A>0.1mol/L。
④甲中a=6,所以在常温下溶液中c(H+)=10-6mol/L,c(OH-)=10-8mol/L.根据电荷守恒可知c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以混合溶液中c(Cl-)-c(NH4+)=c(H+)-c(OH-)=(10-6-10-8)mol/L。
(2)①醋酸钠是强碱弱酸盐,溶于水CH3COO-水解,溶液显碱性,反应的离子方程式为CH3COO-+H2O
 CH3COOH+OH-。
CH3COOH+OH-。②当加入的盐酸的体积为20.0mL时,二者恰好反应生成醋酸和氯化钠,其中c(Cl-)=c(Na+),则根据电荷守恒可知c(CH3COO-)+c(Cl-)+c(OH-)=c(Na+)+c(H+),即c(CH3COO-)+c(OH-)=c(H+),所以c(CH3COO-)=c(H+)-c(OH-)≈c(H+)=1.3×10-3 mol/L。根据物料守恒可知溶液中c(CH3COOH)=0.10mol/L-1.3×10-3 mol/L=98.7×10-3 mol/L,所以CH3COOH的电离平衡常数Ka=
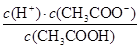 =
=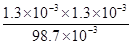 =1.7×10-5。
=1.7×10-5。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
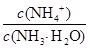 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。