题目内容
【题目】肼(N2H4)是一种高能燃料,在生产和研究中用途广泛。化学小组同学在实验室中用过量NH3和NaC1O溶液反应制取N2H4(液)并探究其性质。回答下列问题:
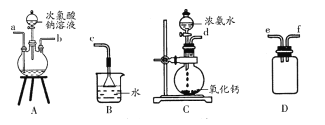
(1)肼的制备
①用上图装置制取肼,其连接顺序为________(按气流方向,用小写字母表示)。
②装置A中发生反应的化学方程式为_________________,装置D的作用是_______________。
(2)探究:N2H4和AgNO3溶液的反应将制得的肼分离提纯后,进行如下实验:
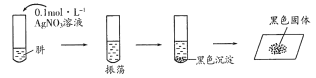
证明黑色沉淀已洗涤干净的操作是__________________________________。
【查阅资料】N2H4水溶液的碱性弱于氨水;N2H4有强还原性。AgOH在溶液中不稳定易分解生成Ag2O;Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】
假设1:黑色固体可能是Ag;
假设2:黑色固体可能是_____________;
假设3:黑色固体可能是Ag和Ag2O。
【实验验证】该同学基于上述假设,设计如下方案,进行实验,请完成下表中的空白部分。
实验编号 | 操作 | 现象 | 实验结论 |
1 | 取少量黑色固体于试管,__________ | 黑色固体不溶解 | 假设1成立 |
2 | 操作同实验1 | 黑色固体完全溶解 | 假设2成立 |
3 | ①取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热②取少量黑色固体于试管中,加入足量稀硝酸,振荡 | ①________________ ②________________ | 假设3成立 |
根据实验现象,假设1成立,则N2H4与AgNO3溶液反应的离子方程式为____________。
【答案】 defabc(ef顺序可互换) NaClO+2NH3=N2H4+NaCl+H2O 防止倒吸或安全瓶 取最后一次洗涤液少许于试管中,滴加NaCl溶液,无白色沉淀生成说明沉淀已洗涤干净。 Ag2O 加入足量氨水,振荡 试管内壁有银镜生成 固态完全溶解,并有气体产生 N2H4+4Ag+=4Ag↓+N2↑+4H+(生成物写成N2H5+、N2H62+也给分)
【解析】(1)①用过量NH3和NaC1O溶液反应制取N2H4(液),根据氨气性质及装置情况,先用C装置制备氨气,再通过D装置安全瓶,再让氨气进入A装置与次氯酸钠溶液反应,最后尾气处理为B装置,正确连接顺序为:defabc(ef顺序可互换);②装置A中氨气与次氯酸钠反应生成肼、氯化钠和水,发生反应的化学方程式为:NaClO+2NH3=N2H4+NaCl+H2O;装置D的作用是防止倒吸或做安全瓶;(2)黑色沉淀若洗涤不干净则含有硝酸银,证明黑色沉淀已洗涤干净的操作是:取最后一次洗涤液少许于试管中,滴加NaCl溶液,无白色沉淀生成说明沉淀已洗涤干净;根据假设1和假设3可推知假设2为:黑色固体可能是Ag2O;Ag2O可溶于氨水而Ag不溶于氨水,则实验1填写:加入足量氨水,振荡;实验3是银镜反应的实验操作,Ag2O溶于氨水生成银氨溶液,与乙醛溶液反应产生银镜,则①的现象为:试管内壁有银镜生成;若黑色固体中还含有银,在稀硝酸作用下反应产生NO,无色气体NO遇空气变成红棕色气体,现象为:固态完全溶解,并有气体产生;根据实验现象,假设1成立,则N2H4与AgNO3溶液反应生成银、氮气,其反应的离子方程式为:N2H4+4Ag+=4Ag↓+N2↑+4H+。

【题目】下列实验操作或事实与预期实验目的或所得结论对应不正确的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 将滴有酚酞的氨水加热,红色逐渐变浅 | NH3·H2O受热分解,导致溶液碱性减弱 |
B | 在酒精灯上加热铝箔,铝箔熔化但不滴落 | Al2O3的熔点高于A1 |
C | 新收集的酸雨 | 酸雨中一定含有SO42- |
0 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性 |
A. A B. B C. C D. D