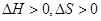题目内容
将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末(Na2O2体积忽略不计)的密闭容器中,用电火花引燃直至反应完全。恢复到原温度,容器内的压强为原来的1/4,则原混合气体的平均相对分子质量不可能是
| A.15 | B.28 | C.30 | D.36 |
AD
试题分析:
①2CO+ O2=2CO2
②2CO2+ 2Na2O2="2" Na2CO3+ O2 (①+②)/2 得CO+ Na2O2= Na2CO3
③2H2+ O2="2" H2O ④2H2 O+2Na2O2="4" Na O H + O2 ↑
(③+④)/2 得 H2 +Na2O2="2" Na O H H2和CO被Na2O2吸收。过量的2CO2+ 2Na2O2="2" Na2CO3+ O2
2 CO2----2 Na2O2---- O2
1/2 1/4
有两种假设:(1)若原气体是H2:1/2和CO21/2 ;(2)若原气体是CO:1/2和CO2:1/2
(1)若原气体是H2:1/2和CO2:1/2 M平均="2*1/2+44*1/2=23"
(2)若原气体是CO:1/2和CO2:1/2 M平均=28*1/2+44*1/2=36
H2、CO和CO2的混合气体在 36 > M平均 > 23 AD不在这个范围,所以不可能。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
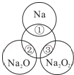
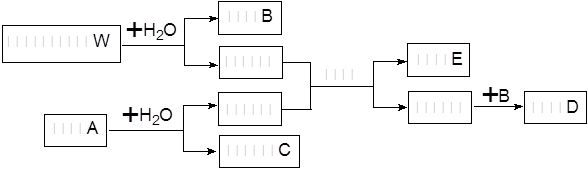
 变灰暗
变灰暗 变白色
变白色 出现液滴
出现液滴 白色固体,
白色固体,