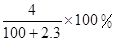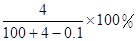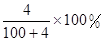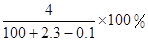题目内容
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
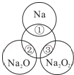

| A.Na2O2中阴阳离子数目之比为1:1 |
| B.反应①的离子方程式为:Na+2H2O=Na++2OH﹣+H2↑ |
| C.反应③最多能产生0.05mol O2 |
| D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
C.
试题分析:A、过氧化钠中阴离子是O2 2﹣,所以阴阳离子数目之比为1:2,故A错误.
B、反应①的离子方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,故B错误.
C、反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,
2mol 1mol
0.1mol 0.05mol
根据方程式知,最多产生0.05mol O2,故C正确.
D、钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+H2↑,溶液增加的质量=m(Na)﹣m(H2)=2.3g﹣0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+O2↑,溶液增加的质量=m(Na2O2)﹣m(O2)=m(Na2O)=6.2g
所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、分别溶于水所得溶液的质量分数分别为:
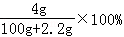 、
、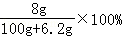 、
、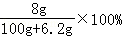 ,所以①、②、③充分反应后所得溶液的质量分数从大到小:①<②=③,故D错误.
,所以①、②、③充分反应后所得溶液的质量分数从大到小:①<②=③,故D错误.
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
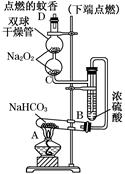
 Na2O2和
Na2O2和 NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,
NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,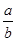 值可能为
值可能为