题目内容
【题目】党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了 PM2.5外,还有 CO、SO2、氮氧化物(NO和 NO2)、O3等气体。
完成下列填空:
(1)S2- 的核外电子排布式为__________, N原子核外电子有______种不同运动状态。
(2)C、O、S、N 四种元素中原子半径最小的是________(写元素符号);写出一个比较O与N非金属性强弱的事实: _____________________________________________。
(3)汽车尾气中含有NO和CO气体,用以下反应除去:2CO(g) +2NO(g) ![]() N2(g) +2CO2 (g) + Q
N2(g) +2CO2 (g) + Q
①该反应的平衡常数表达式为________________________;
②若增大压强,平衡常数__________(填“增大”、 “减小”或“不变”);
③若升高温度,逆反应速率先增大后减小,则 Q ______0(填“>”、 “<”或“=”)。
(4)某温度时,将 0.1mol CO和 0.1mol NO充入2L的密闭容器中,5s后测得生成 0.28g N2,则该时间内v(NO) = _______________。
【答案】 1s22s22p63s23p6 7 O NO中氮元素的化合价为+2,氧元素为-2(合理即可) 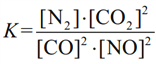 不变 > 0.002mol/(L·s)
不变 > 0.002mol/(L·s)
【解析】(1)S为16号元素,S2- 核外有18个电子,其核外电子排布式为:1s22s22p63s23p6;原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,氮原子核外有7个电子,所以有7种不同运动状态。
故答案为:1s22s22p63s23p6;7;
(2)原子电子层数越大,半径越大;电子层数相同时,核电荷数越多半径越小。则C、O、S、N 四种元素中原子半径最小的为O元素;几种非金属元素同处于一种物质中,可用化合价判断其非金属性强弱,NO中氮元素的化合价为+2,氧元素为-2,说明O元素非金属性强于N元素;非金属单质与H2化合越容易,非金属性越强,O2与H2反应,比N2与H2反应容易,说明O元素的非金属性强于N元素。
故答案为:O;NO中氮元素的化合价为+2,氧元素为-2(或O2与H2反应,比N2与H2反应容易);
(3)①平衡常数K=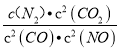 ;
;
②平衡常数只与温度有关,温度不变,平衡常数不变。
③升高温度,吸热反应速率和放热反应速率瞬间都增大,但吸热反应速率增得更多,所以吸热反应开始逐渐减小,放热反应开始逐渐增大,直到两个反应速率相等,达到新的平衡状态。本题中逆反应速率先增大后减小,则逆反应为放热反应,正反应为吸热反应,故△H>O。
故答案为:K=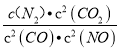 ;不变;>;
;不变;>;
(4)5s后生成 0.28g N2,即生成了0.01molN2,物质的量变化量之比等于系数之比,所以5s内NO变化了0.02mol。v(NO)= ![]() = 0.002mol/(L·s);
= 0.002mol/(L·s);
故答案为:0.002mol/(L·s);
