��Ŀ����
����Ŀ��H�Ǻϳɿ���ҩ��������ƵĹؼ��м��壬����һ�ֺϳ�·�����£�
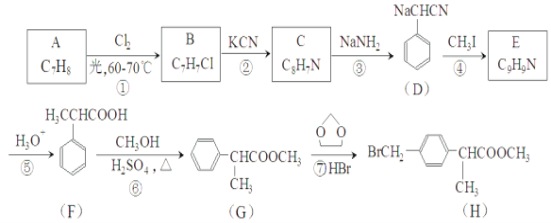
(1)A�Ļ�ѧ����Ϊ___________��
(2)G�ķ���ʽΪ___________��H�й����ŵ�������___________��
(3)E�Ľṹ��ʽΪ___________����Ӧ�ڵķ�Ӧ����Ϊ___________��
(4)��Ӧ�Ļ�ѧ����ʽΪ___________��
(5)д��ͬʱ��������������F��ͬ���칹��Ľṹ��ʽ___________��
�����ܷ���ˮ�ⷴӦ������ʹ�
�����ܷ���������Ӧ
�����˴Ź���������5����ҷ����֮��Ϊ3��2��2��2��1
(6)����H�ĺϳ��ߣ����һ����![]() �ϳ�
�ϳ�![]() �ĺϳ�·��______��
�ĺϳ�·��______��
���𰸡��ױ� C10H12O2 ��ԭ�ӡ�����  ȡ����Ӧ
ȡ����Ӧ 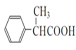 +HOCH3
+HOCH3![]()
![]() +H2O
+H2O 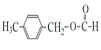
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��������
��D�ṹ��ʽ֪��A�к��б��������A����ʽ֪��AΪ![]() ����B����ʽ��D�ṹ��ʽ֪��A��������ȡ����Ӧ����B��BΪ
����B����ʽ��D�ṹ��ʽ֪��A��������ȡ����Ӧ����B��BΪ![]() ��CΪ
��CΪ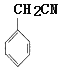 ����F�ṹ��ʽ֪����Ϊȡ����Ӧ��EΪ
����F�ṹ��ʽ֪����Ϊȡ����Ӧ��EΪ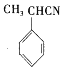 ��F����������Ӧ����G��G����ȡ����Ӧ����H��
��F����������Ӧ����G��G����ȡ����Ӧ����H��
(6)��![]() �ϳ�
�ϳ�![]() ��
��![]() ��
��![]() ��
��![]() ����������Ӧ�õ���
����������Ӧ�õ���![]() ������
������![]() ˮ��õ���
ˮ��õ���![]() ����
����![]() ��KCN��Ӧ�õ���
��KCN��Ӧ�õ���
(1) AΪ![]() ������Ϊ�ױ���
������Ϊ�ױ���
(2)G�Ľṹ��ʽΪ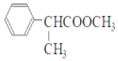 ������ʽΪC10H12O2��HΪ
������ʽΪC10H12O2��HΪ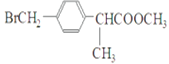 �������ŵ���������ԭ�ӡ�������
�������ŵ���������ԭ�ӡ�������
(3)�����Ϸ�����֪��E�Ľṹ��ʽΪ ��BΪ
��BΪ![]() ��CΪ
��CΪ ���ʷ�Ӧ��ΪE�е���ԭ�ӱ�-CNȡ���ķ�Ӧ����Ӧ����Ϊȡ����Ӧ��
���ʷ�Ӧ��ΪE�е���ԭ�ӱ�-CNȡ���ķ�Ӧ����Ӧ����Ϊȡ����Ӧ��
(4)��Ӧ����������Ӧ����ѧ����ʽΪ +HOCH3
+HOCH3![]()
![]() +H2O��
+H2O��
(5) �����ܷ���ˮ�ⷴӦ������ʹ���˵������������
�����ܷ���������Ӧ��˵������ȩ����
�����˴Ź���������5����ҷ����֮��Ϊ3��2��2��2��1��˵���ṹ�Գ����м�������������F��ͬ���칹��Ľṹ��ʽ![]() ��
��
(6) ��![]() �ϳ�
�ϳ�![]() ��
��![]() ����
����![]() ��
��![]() ����������Ӧ�õ���
����������Ӧ�õ���![]() ������
������![]() ˮ��õ���
ˮ��õ���![]() ����
����![]() ��KCN��Ӧ�õ���
��KCN��Ӧ�õ���![]() ������
������![]() �õ����ʺϳ�·��Ϊ
�õ����ʺϳ�·��Ϊ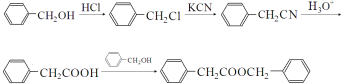 ��
��