题目内容
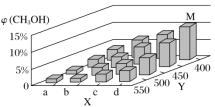
【题目】有关甲、乙、丙、丁四个图示的叙述不正确的是( )
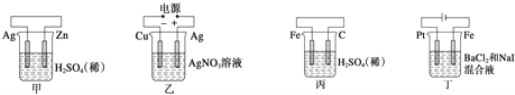
A.甲中负极反应式为![]()
B.乙中阳极反应式为![]()
C.丙中![]() 向碳棒方向移动
向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
【答案】D
【解析】
由甲、乙、丙、丁四幅图可知,甲图是原电池,金属锌作负极,银作正极;乙图为电解池,铜作阴极,银作阳极;丙图为原电池,铁作负极,碳棒作正极;丁图为电解池,Pt为阳极,铁为阴极,据此判断。
A. 甲图是原电池,金属锌作负极,银作正极,负极反应式为![]() ,A项正确;
,A项正确;
B. 乙图为电解池,铜作阴极,银作阳极,阳极反应式为![]() ,B项正确;
,B项正确;
C. 丙图为原电池,铁作负极,碳棒作正极,阳离子移动到正极,故![]() 向碳棒方向移动,C项正确;
向碳棒方向移动,C项正确;
D. 丁图为电解池,Pt为阳极,铁为阴极,电解开始时阳极I-放电,D项错误;
答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目