题目内容
在一容积为2L的密闭容器中,充入4mol氮气和12mol氢气,使其在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g),2min末测得NH3为0.8mol,则:
2NH3(g),2min末测得NH3为0.8mol,则:
(1)以N2的浓度变化表示该反应在2min内的平均反应速率为 ;
(2)H2在2min末的体积分数为 (保留两位有效数字);
(3)2min末N2的转化率为 ;
(4)已知在25℃,101kPa下,拆开1mol N2中的化学键需消耗946kJ的能量,拆开1mol H2中的H—H键要消耗436kJ的能量,而形成1mol N—H键会放出391kJ的能量。试通过以上数据计算当反应掉1molN2和3molH2生成2molNH3时会 (填“放出”或“吸收”) 热量;
(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于上述计算值,你认为最可能的原因是 。
 2NH3(g),2min末测得NH3为0.8mol,则:
2NH3(g),2min末测得NH3为0.8mol,则:(1)以N2的浓度变化表示该反应在2min内的平均反应速率为 ;
(2)H2在2min末的体积分数为 (保留两位有效数字);
(3)2min末N2的转化率为 ;
(4)已知在25℃,101kPa下,拆开1mol N2中的化学键需消耗946kJ的能量,拆开1mol H2中的H—H键要消耗436kJ的能量,而形成1mol N—H键会放出391kJ的能量。试通过以上数据计算当反应掉1molN2和3molH2生成2molNH3时会 (填“放出”或“吸收”) 热量;
(5)若将1mol N2和3molH2置于绝热密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于上述计算值,你认为最可能的原因是 。
(每空1分,共6分,无单位或单位写错不得分)
(1)0.1 mol/(L?min)
(2)71%
(3)10%
(4)放出 ; 92kJ
(5)反应N2+3H2 2NH3是可逆反应,1mol N2和3molH2不能完全转化成2 molNH3。
2NH3是可逆反应,1mol N2和3molH2不能完全转化成2 molNH3。
(1)0.1 mol/(L?min)
(2)71%
(3)10%
(4)放出 ; 92kJ
(5)反应N2+3H2
 2NH3是可逆反应,1mol N2和3molH2不能完全转化成2 molNH3。
2NH3是可逆反应,1mol N2和3molH2不能完全转化成2 molNH3。试题分析: N2(g)+3H2(g)
 2NH3(g)
2NH3(g)开始的物质的量 4mol 12mol 0mol
反应的物质的量 0.4mol 1.2mol 0.8mol
2min末物质的量 3.6mol 10.8mol 0.8mol
(1)v(N2)=△c(N2)÷t=△n(N2) ÷V÷t=0.4mol÷2L÷2min=0.1mol/(L·min)
(2)H2在2min末的体积分数为10.8mol÷(3.6mol+10.8mol+0.8mol)×100%=71%。
(3)2min末N2的转化率为0.4mol÷4mol×100%=10%。
(4)△H=391kJ×2-946kJ+436kJ×3=-1472。故当反应掉1molN2和3molH2生成2molNH3时会放出热量。
(5)反应为可逆反应,反应物不能完全转化为生成物。
点评:本题较难,考查化学平衡中等效平衡的计算,明确温度与压强不变时,起始反应物的量成正比则平衡等效是解答本题的关键。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 (气)+5
(气)+5 (气)
(气) 4NO(气)+6
4NO(气)+6 (气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.54mol,则此反应的平均速率
(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.54mol,则此反应的平均速率 (X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
(X)(反应物的消耗速率或产物的生成速率)可表示为 ( ) 2C+D来说,下列反应速率最快的是 ( )
2C+D来说,下列反应速率最快的是 ( )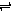 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol?L-1,
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol?L-1, Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( )
Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( ) xC(g),2min 时反应达到平衡状态(温度保持不变),剩余0.8 molB,C的浓度为0.4mol·L-1,请填空:
xC(g),2min 时反应达到平衡状态(温度保持不变),剩余0.8 molB,C的浓度为0.4mol·L-1,请填空: