题目内容
反应3X(g)+Y(g) 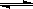 Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( )
Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( )
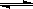 Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( )
Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( )| A.V(Y)=0.02mol·L—1·min—1 | B.V(Z)=0.10mol·L—1·min—1 |
| C.V(X) =0.03mol·L—1·min—1 | D.V(W)=0.02mol·L—1·s—1 |
C
试题分析:在2L密闭容器中进行,5min内Y减少了0.1mol,所以v(Y)=0.1mol÷2L÷5min=0.01mol/(L?min)。
A、v(Y)=0.1mol÷2L÷5min =0.01mol/(L?min),故A错误;
B、速率之比等于化学计量数之比,所以v(Z)=v(Y)=0.01mol/(L?min),故B错误;
C、速率之比等于化学计量数之比,所以v(X)=3v(Y)=0.03mol/(L?min),故C正确;
D、速率之比等于化学计量数之比,所以v(W)=2v(Y)=0.02mol/(L?min)=1.2mol/(L?S),故D错误.
故选C。
点评:本题考查化学反应速率的计算,难度较小,反应速率计算通常有定义法、化学计量数法,根据情况选择使用。

练习册系列答案
相关题目
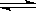 xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求: CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )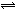 2NH3(g),2min末测得NH3为0.8mol,则:
2NH3(g),2min末测得NH3为0.8mol,则: 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( )
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为( ) 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6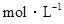 ,在此时间内用NH3表示的反应速率为0.30
,在此时间内用NH3表示的反应速率为0.30
 4NO+6H2O(g);△H=-Q1 kJ/mol(Q1>0)
4NO+6H2O(g);△H=-Q1 kJ/mol(Q1>0) 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为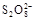 =I3- +2SO42-的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42-的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表: