题目内容
(13分)请你与某小组的同学共同探究乙醇与乙酸的酯化反应实验:

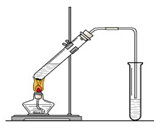
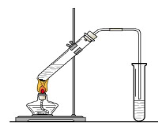
(1) 请你根据图示,补画实验室制取乙酸乙酯的装置图。
(2) 其中小试管中装入的物质是____________;其主要作用是 、 ____________、__________________________。
(3) 分离小试管中制取的乙酸乙酯应使用的仪器叫做______________;分离完毕,应从该仪器________________ (填“下口放”或“上口倒”)出。
(4) 实验完毕,发现大试管中的反应液有些变黑,其原因是________________________。
(5) 该实验中,若用3mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯? (填“能”或“不能”),原因是 (不考虑原料损耗)。
(6) 写出该反应的化学方程式:

(1) 请你根据图示,补画实验室制取乙酸乙酯的装置图。
(2) 其中小试管中装入的物质是____________;其主要作用是 、 ____________、__________________________。
(3) 分离小试管中制取的乙酸乙酯应使用的仪器叫做______________;分离完毕,应从该仪器________________ (填“下口放”或“上口倒”)出。
(4) 实验完毕,发现大试管中的反应液有些变黑,其原因是________________________。
(5) 该实验中,若用3mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯? (填“能”或“不能”),原因是 (不考虑原料损耗)。
(6) 写出该反应的化学方程式:
(1) 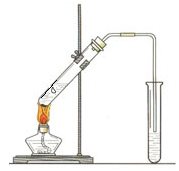 (2分)
(2分)
(2) 饱和Na2CO3溶液;中和乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度。
(3) 分液;上口倒
(4) 热浓硫酸将反应剩余的乙醇和乙酸炭化
(5) 不能,该反应是可逆反应,转化率不能达到100%
(6) CH3COOH+ C2H5OH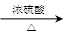 CH3COOC2H5+H2O(2分)
CH3COOC2H5+H2O(2分)
 (2分)
(2分)(2) 饱和Na2CO3溶液;中和乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度。
(3) 分液;上口倒
(4) 热浓硫酸将反应剩余的乙醇和乙酸炭化
(5) 不能,该反应是可逆反应,转化率不能达到100%
(6) CH3COOH+ C2H5OH
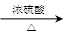 CH3COOC2H5+H2O(2分)
CH3COOC2H5+H2O(2分)(1)乙酸乙酯的制取属于液体和液体之间通过加热制取,为了防止暴沸还需要加入碎瓷片,装置如图所示。
(2)由于生成的乙酸乙酯中会混入乙酸和乙醇,所以为了除去乙酸和乙醇,需要加入饱和碳酸钠溶液,作用是中和乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度。
(3)乙酸乙酯不溶于水,可以通过分液进行分离。分液的主要仪器是分液漏斗。因为乙酸乙酯的密度小于水的,所以要从上口倒出。
(4)由于浓硫酸具有脱水性,因此在反应过程中有可能将反应剩余的乙醇和乙酸炭化,从而使反应液变黑。
(5)由于酯化反应是可逆反应,所以不可能生成1mol乙酸乙酯。
(6)反应的方程式为CH3COOH+ C2H5OH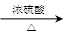 CH3COOC2H5+H2O。
CH3COOC2H5+H2O。
(2)由于生成的乙酸乙酯中会混入乙酸和乙醇,所以为了除去乙酸和乙醇,需要加入饱和碳酸钠溶液,作用是中和乙酸、溶解乙醇、降低乙酸乙酯在水中的溶解度。
(3)乙酸乙酯不溶于水,可以通过分液进行分离。分液的主要仪器是分液漏斗。因为乙酸乙酯的密度小于水的,所以要从上口倒出。
(4)由于浓硫酸具有脱水性,因此在反应过程中有可能将反应剩余的乙醇和乙酸炭化,从而使反应液变黑。
(5)由于酯化反应是可逆反应,所以不可能生成1mol乙酸乙酯。
(6)反应的方程式为CH3COOH+ C2H5OH
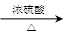 CH3COOC2H5+H2O。
CH3COOC2H5+H2O。
练习册系列答案
相关题目

 。
。 的名称为甲氟磷酸,则“沙林” 的化学名称为
的名称为甲氟磷酸,则“沙林” 的化学名称为