��Ŀ����
����Ŀ���ۺ��⡣
��1����ӦFe��s��+CO2��g��FeO��s��+CO��g����H1 �� ƽ�ⳣ��ΪK1����ӦFe��s��+H2O��g��FeO��s��+H2��g����H2 �� ƽ�ⳣ��ΪK2 �� �ڲ�ͬ�¶�ʱK1��K2��ֵ�����
700�� | 900�� | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
�ٷ�Ӧ CO2��g��+H2��g��CO��g��+H2O��g����H��ƽ�ⳣ��K�����H=���á�H1�͡�H2��ʾ����K=����K1��K2��ʾ�����������������֪����ӦCO2��g��+H2��g��CO��g��+H2O��g������Ӧ������ȡ����ȡ�����
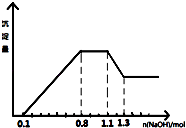
��2��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬������ӦFe��s��+CO2��g��FeO��s��+CO��g����H��0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
�ٸ������·�Ӧ��ƽ�ⳣ��Ϊ��
�����д�ʩ����ʹƽ��ʱ ![]() �������������ţ�
�������������ţ�
A�������¶� B������ѹǿ
C������һ������CO2 D���ټ���һ��������
��һ���¶��£���һ���̶��ݻ����ܱ������з���������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����������ĸ����
a��������ѹǿ���� b��������ܶȲ��ٸı�c��v����CO2��=v����CO�� d��c��CO2��=c��CO�� e�����������������ʵ������䣮
���𰸡�
��1����H1����H2��![]() ������
������
��2��2.0��A��bc
���������⣺��1����Fe��s��+CO2��g��FeO��s��+CO��g����H1 �� ƽ�ⳣ��ΪK1���ڷ�ӦFe��s��+H2O��g��FeO��s��+H2��g����H2 �� ƽ�ⳣ��ΪK2 ��
��ϸ�˹���ɿ�֪���٩��ڵõ�CO2��g��+H2��g��CO��g��+H2O��g����
���H=��H1����H2��K= ![]() ����ϱ������ݿ�֪
����ϱ������ݿ�֪ ![]() ��
�� ![]() ���������¶�K��������ӦΪ���ȷ�Ӧ��
���������¶�K��������ӦΪ���ȷ�Ӧ��
���Դ��ǣ���H1����H2�� ![]() �����ȣ���2����Fe��s��+CO2��g��FeO��s��+CO��g��
�����ȣ���2����Fe��s��+CO2��g��FeO��s��+CO��g��
��ʼ 1.5 0
ת�� 1 1
ƽ�� 0.5 1
�÷�Ӧ ��ƽ�ⳣ��K= ![]() =2.0��
=2.0��
���Դ��ǣ�2.0����A���ɱ�����K1�ı仯������ӦΪ���ȷ�Ӧ���������¶ȣ�ƽ�������ƶ�����ʹƽ��ʱ ![]() ����Aѡ��
����Aѡ��
B������ѹǿ��ƽ�ⲻ�ƶ�����B��ѡ��
C������һ������CO2 �� ƽ�������ƶ�����ƽ��ʱ ![]() ��С����C��ѡ��
��С����C��ѡ��
D���ټ���һ�������ۣ�ƽ�ⲻ�ƶ�����D��ѡ��
���Դ��ǣ�A����a���÷�ӦΪ�������ķ�Ӧ��������ѹǿʼ�ղ��䣬�����ж�ƽ��״̬���ʲ�ѡ��
b��������䣬������Ϊ������������ܶȲ��ٸı䣬Ϊƽ��״̬����ѡ��
c��v����CO2��=v����CO������֪���淴Ӧ������ȣ�Ϊƽ��״̬����ѡ��
d��c��CO2��=c��CO��������ʼŨ�ȡ�ת�����йأ������ж�ƽ��״̬���ʲ�ѡ��
e�����������������ʵ���ʼ�ղ��䣬�����ж�ƽ��״̬���ʲ�ѡ��
���Դ��ǣ�bc��
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��״̬���ʼ����������֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��������ȷ�����⣮

����Ŀ���ݡ��ο���Ϣ���������п�ѧ��������ǡ�21���͵���Դ������δ����ʯ�͡��Ĺ۵㣮
��1���������������ȼ�յ��Ȼ�ѧ����ʽΪSi��s��+O2��g���TSiO2��s����H=��989.2kJmol��1 �� �йؼ����������±���
��ѧ�� | Si��O | O=O | Si��Si |
����kJmol��1 | x | 498.8 | 176 |
��֪1molSi�к�2molSi��Si����1molSiO2�к�4molSi��O������x��ֵΪ ��
��2���������Ϊһ���ձ�ʹ�õ�������Դ���������ã��������������ص�����˵���У�����Ϊ�������� ��
A.��������䡢���棬�Ӱ�ȫ�Ƕȿ��ǣ�������ѵ�ȼ��
B.�����Դ�ḻ�����ڿ��ɣ��ҿ�����
C.��ȼ�շų�����������ȼ�ղ���Ի�����Ⱦ�̶ȵͣ�������Ч����
D.Ѱ�Ҹ�Ч�´���������ʹ��ӦSiO2+2C ![]() Si+2CO���ڳ����·������ǹ���Դ�������õĹؼ�����
Si+2CO���ڳ����·������ǹ���Դ�������õĹؼ�����
��3����ҵ�Ʊ�����ķ�ӦΪ2H2��g��+SiCl4��g���TSi��s��+4HCl��g����H=+240.4kJmol��1 �� ���ɵ�HClͨ��100mL 1molL��1��NaOH��Һǡ����ȫ�����գ��������Ʊ�����ķ�Ӧ������������ա����ͷš���������ΪkJ��