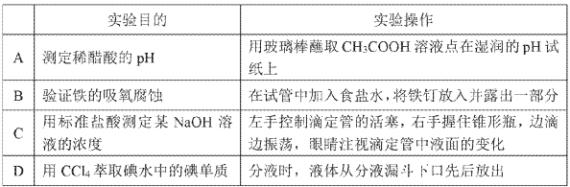
题目内容
【题目】某些物质的转化可用下图表示
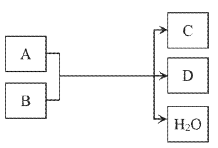
请回答下列问题
(1)完成反应方程式:
______Ca(OH)2+_____NaHCO3(过量)=______+_____+_______H2O,___________
(2)若A、C均含有铝元素:
①当B为盐酸时,C为___________;
②当B为NaOH时,C为___________。
(3)若A为第二周期黑色固体单质,B为第二周期某元素的最高价氧化物的水化物。写出该反应的化学方程式______________________。
(4)若A为过量铁粉、B为稀硝酸,检验溶液中金属阳离子的方法是___________。
(5)若C为能使湿润红色石蕊试纸变蓝的气体。实验室为了简便制取该气体,下列方法中适合的是___________
A.加热氯化铵固体,产生的气体用碱石灰干燥
B.在N2和H2混合气中加入铁触媒并加热至500℃
C.在浓氨水中加入NaOH固体,产生的气体可用固体NaOH干燥
D.加热NH4HCO3,生成的气体用P2O5干燥
(6)若A为S单质,D为Na2SO3:
①Na2SO3溶液中各离子浓度由大到小的顺序为___________。
②C的浓溶液有臭鸡蛋气味,配制C溶液的方法是___________。
【答案】1,2,CaCO3↓,Na2CO3,2 AlCl3 NaAlO2 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 取反应后溶液,滴加到少量KMnO4溶液中,紫红色褪去 C c(Na+)>c(SO32-)>cOH-)>c(HSO3-)>c(H+) 取Na2S固体溶解在浓NaOH溶液中,再加水稀释
CO2↑+4NO2↑+2H2O 取反应后溶液,滴加到少量KMnO4溶液中,紫红色褪去 C c(Na+)>c(SO32-)>cOH-)>c(HSO3-)>c(H+) 取Na2S固体溶解在浓NaOH溶液中,再加水稀释
【解析】
(1)依据过量的碳酸氢钠和氢氧化钙反应方程式填写;
(2)若A、C均含有铝元素①当B为盐酸时,依据盐酸和铝反应可知,C为AlCl3;
②当B为NaOH时,C为NaAlO2。
(3)若A为第二周期黑色固体单质,则A为C,B为第二周期某元素的最高价氧化物的水化物,B为HNO3,;
(4)若A为过量铁粉、B为稀硝酸,则溶液中的金属阳离子是Fe2+,
(5)若C为能使湿润红色石蕊试纸变蓝的气体,则C为NH3;
(6)若A为S单质,D为Na2SO3;则反应为:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O;
2Na2S+Na2SO3+3H2O;
①Na2SO3是强碱弱酸盐,在溶液中发生水解,溶液显碱性;
②C的浓溶液有臭鸡蛋气味,所以C是Na2S,配制该溶液是应防止其水解;
(1)过量的碳酸氢钠和氢氧化钙反应的方程式为:Ca(OH)2+2NaHCO3(过量)=CaCO3![]() +Na2CO3+2H2O;
+Na2CO3+2H2O;
本题答案为:1,2,CaCO3↓,Na2CO3,2。
(2)若A、C均含有铝元素①当B为盐酸时,依据盐酸和铝反应可知,C为AlCl3;
②当B为NaOH时,C为NaAlO2;
本题答案为:AlCl3 , NaAlO2。
(3)有分析知道,A是C,B是HNO3,则反应方程式为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
本题答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。
(4)若A为过量铁粉、B为稀硝酸,则溶液中的金属阳离子是Fe2+,检验Fe2+的方法是:取反应后溶液少许于试管中,滴加到少量KMnO4溶液中,紫红色褪去;
本题答案为:取反应后溶液,滴加到少量KMnO4溶液中,紫红色褪去。
(5)若C为能使湿润红色石蕊试纸变蓝的气体,则C为NH3,实验室制取NH3的简便方法是:在浓氨水中加入NaOH固体,产生的气体可用固体NaOH干燥;
本题答案为:C。
(6)若A为S单质,D为Na2SO3;则反应为:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O;
2Na2S+Na2SO3+3H2O;
①Na2SO3是强碱弱酸盐,在溶液中发生水解,溶液显碱性,Na2SO3溶液中各离子浓度由大到小的顺序为:c(Na+)>c(SO32-)>cOH-)>c(HSO3-)>c(H+);
本题答案为:c(Na+)>c(SO32-)>cOH-)>c(HSO3-)>c(H+)。
②C的浓溶液有臭鸡蛋气味,是因为Na2S水解产生H2S的原因,配制该溶液时应加入氢氧化钠抑制其水解,所以取Na2S固体溶解在浓NaOH溶液中,再加水稀释,来配制Na2S溶液;
本题答案为:取Na2S固体溶解在浓NaOH溶液中,再加水稀释。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案