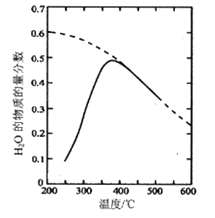
题目内容
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是
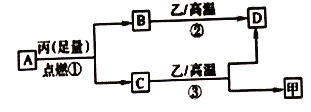
A. 原子半径:Z>Y>X B. 稳定性:A>C
C. 反应②和③均为吸热反应 D. X、Y、Z可以形成离子化合物
【答案】C
【解析】短周期元素中形成的10个电子的化合物主要有CH4、NH3、H2O、HF等几种,根据图中的转化关系可以推出X、Y、Z分别为H、C、O 三种元素,甲、乙、丙分别为氢气、碳、氧气,A、B、C、D分别为CH4、CO2、H2O、CO。
A. H、C、O 三种元素原子半径:C>O>H ,A不正确; B. 氧元素的非金属性强于碳,所以稳定性:H2O>CH4,B不正确;C. 反应②碳和二氧化碳在高温下生成一氧化碳的反应是吸热反应,反应③水蒸气和碳在高温下反应生成氢气和一氧化碳是吸热反应 ,所以C正确; D. H、C、O三种非金属元素只能形成共价化合物,不能形成离子化合物,D不正确。选C。

练习册系列答案
相关题目
【题目】某温度下,N2O5在CCl4中发生反应:2N2O5===4NO2+O2,N2O5的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
N2O5/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A. v(N2O5)=0.032 mol·L-1
B. v(N2O5)=0.050 mol·L-1
C. v(N2O5)=0.050 mol·L-1·s-1
D. v(N2O5)=0.032 mol·L-1·s-1