题目内容
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
sabatior反应:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
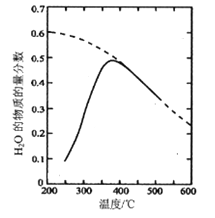
(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
①己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=___kJ/mol。
②温度过高或过低均不利于该反应的进行,原因是________。
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g)![]() C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H
①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H___ 0(填“>”“<”或“不确定”) ;若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I 曲线b所示,则改变的条件是______________。
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____________(填“甲”或“乙”):m值为____________。

③Bosch反应必须在高温下才能启动,原因是__________________。
【答案】 4A-B+2C (2分)或(-4A+B+2C) 温度过低,反应速率小;温度过高,平衡向右进行的程度小 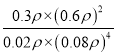 BCE < 加入催化剂 乙 2 反应的活化能高
BCE < 加入催化剂 乙 2 反应的活化能高
【解析】(1)①己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol,则
ⅰ、O2(g)+2H2(g)=2H2O(l) △H =2A kJ/mol
ⅱ、2O2(g)+CH4(g)=2H2O(l)+CO2(g) △H =B kJ/mol
ⅲ、H2O(l)=H2O(g) △H =CkJ/mol
根据盖斯定律可知ⅰ×2-ⅱ+ⅲ×2即得到Sabatier反应的△H=(4A-B+2C)kJ/mol。
②温度过低,反应速率很小;温度过高,反应向右进行的程度小,故温度过高或过低均不利于该反应的进行。③200℃时平衡体系中H2O(g)的物质的量分数为0.6,根据反应化学方程式CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),所以CH4的物质的量分数为0.3,因此CO2和H2的物质的量分数共为0.1,又因为原料气按
CH4(g)+2H2O(g),所以CH4的物质的量分数为0.3,因此CO2和H2的物质的量分数共为0.1,又因为原料气按![]() ∶
∶![]() =1∶4置于密闭容器中发生Sabatier反应,所以CO2的物质的量分数为0.02,H2的物质的量分数为0.08;达到平衡时体系的总压强为p,则四种物质的分压分别为:p(CO2)=0.02p、p(H2)=0.08p、p(CH4)=0.3p、p(H2O)=0.6p,所以该反应平衡常数Kp为:
=1∶4置于密闭容器中发生Sabatier反应,所以CO2的物质的量分数为0.02,H2的物质的量分数为0.08;达到平衡时体系的总压强为p,则四种物质的分压分别为:p(CO2)=0.02p、p(H2)=0.08p、p(CH4)=0.3p、p(H2O)=0.6p,所以该反应平衡常数Kp为: 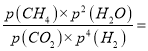
![]() 。
。
(2)首先明确:转化效率不等于转化率。A、适当减压化学反应速率降低、降低平衡转化率,A错误;B、增大催化剂的比表面积,提高了化学反应速率,能提高CO2转化效率,B正确;C、反应器前段加热,加快反应速率,后段冷却,提高平衡转化率,C正确;D、提高原料气中CO2所占比例,降低CO2的转化率,D错误;E、合理控制反应器中气体的流速,可使反应物充分反应,提高了CO2转化效率,E正确。答案选BCE。
(3)①由图1分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随反应进行温度升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变为:△H<0;根据图像可知改变条件后缩短了达到平衡的时间,但并没有改变平衡状态,则改变的条件是加入催化剂。②正反应放热,升高温度平衡向逆反应方向进行,平衡常数减小,则正确的曲线是乙;根据方程式可知:
CO2(g)+2H2(g)![]() C(s)+2H2O(g)
C(s)+2H2O(g)
起始浓度(mol/L) 0.02 0.04 0
变化浓度(mol/L) x 2x 2x
平衡浓度(mol/L) 0.02-x 0.04-2x 2x
压强之比等于物质的量之比,则6/5=(0.02+0.04)/(0.06x),解得:x=0.01,所以平衡常数K=![]() ,所以lgK=lg100=2=m。③Bosch反应为放热反应,一定条件下必须在高温下才能启动,说明高温条件才能引发此反应开始,故该反应的活化能很高。
,所以lgK=lg100=2=m。③Bosch反应为放热反应,一定条件下必须在高温下才能启动,说明高温条件才能引发此反应开始,故该反应的活化能很高。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】在密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得如下数据。
CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得如下数据。
实验 序号 | 温度(℃) | 初始CO浓 度(mol·L-1) | 初始H2O浓 度(mol·L-1) | CO的平衡 转化率 |
1 | 110 | 1 | 1 | 50% |
2 | 100 | 1 | 1 | x |
3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后达到平衡,H2的平均反应速率为________mol·L-1·h-1。在此实验的平衡体系中,再加入0.5molCO和0.5molH2,平衡将________移动(“向左”、“向右”、“不”或“无法确定”)。
(2)实验2中,x的值________(填序号)。
A.等于50% B.大于50%
C.小于50% D.无法确定
(3)实验3中的y值为________。
(4)在100 ℃条件下,能说明该反应达到平衡状态的是________。
A.压强不再变化
B.生成H2O的速率和消耗H2速率相等时
C.混合气体的密度不变
D.H2的质量不再变化
【题目】下列选项中关于物质的性质和用途的说法均正确且有因果关系的是
选项 | 性质 | 用途 |
A | 溴化银有感光性 | 用于变色玻璃 |
B | 新制氯水显酸性 | 漂白有色布条 |
C | 浓硫酸有强氧化性 | 干燥剂 |
D | 氨气是碱性气体 | 液氨作制冷剂 |
A. A B. B C. C D. D