题目内容
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
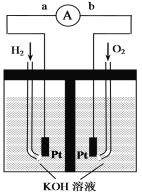
(1)氢氧燃料电池的能量转化主要形式是_______,在导线中电子流动方向为____(用a、b表示)。
(2)负极反应式为_________________________。
(3)电极表面镀铂粉的原因为______________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LiH
2LiH
II.LiH+H2O =LiOH+H2↑
①反应Ⅰ中的还原剂是___,反应II中的氧化剂 是_____。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为_________mol。
【答案】由化学能转变为电能 由a到b 2H2+4OH--4e- = 4H2O 或H2+2OH--2e- = 2H2O 增大电极单位面积吸附H2、O2分子数,加快电极反应速率,同时也增大了Pt的利用率以降低成本 Li H2O 1/1148或8.71×10-4 32
【解析】
(1)原电池的能量转化形式主要是将化学能转化为电能;
(2)负极发生的是氧化反应,对应通氢气的一极,注意所给介质为碱性;
(3)在氢氧燃料电池中,多孔的铂片可以直接作电极。本题中在电极表面镀上一层细小的铂粉,从题干强调的“细”、“粉”,“吸附气体的能力强”进行分析表述。
(4)通过价态变化进行氧化剂和还原剂的判断。通过所给的化学方程式进行求算。
(1)氢氧燃料电池作为原电池,其能量转化主要形式是化学能变为电能;通入H2的a电极为负极,通入O2的b电极为正极,电子从负极经外电路流向正极,所以导线中电子流动方向为由a到b;
(2)所给介质为强碱性介质,所以负极的电极反应式为: H2+2OH--2e-= 2H2O,如考虑与正极电极反应式从形式上即可看出得失电子数相等,该电极反应式也可以写成:2H2+4OH--4e-=4H2O;
(3)电极表面镀铂粉的原因为:镀上铂粉,可以增大该电极单位面积吸附H2、O2分子数,从而加快电极反应的速率。与直接使用多孔铂电极相比,降低了成本而提高了贵金属Pt的利用率;
(4)①从价态变化可以明显看出,反应Ⅰ中Li的化合价由0价升至+1价,还原剂是Li,反应II,LiH中H的化合价为-1价,水中H的化合价为+1价,产物H2既是氧化产物又是还原产物,氧化剂是H2O;
②标准状况下224 LH2的物质的量为10mol,用锂吸收生成的LiH的物质的量为20mol,其质量为20mol×8g/mol=160g,又知LiH的密度为0.82g/cm3,所以生成的LiH的体积为:![]() =195.12cm3,所以生成的LiH体积与被吸收的H2体积比为:
=195.12cm3,所以生成的LiH体积与被吸收的H2体积比为:![]() =
=![]() (或8.71×10-4);
(或8.71×10-4);
③由②生成的LiH为20mol,与H2O作用,放出的H2为20mol;这些氢气用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为:20mol×2×80%=32mol。

【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)

实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。