题目内容
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
【答案】 负 CH3OH+H2O-6e-===CO2+6H+ 还原 O2+4H++4e-===2H2O 2CH3OH+3O2===2CO2+4H2O ![]()
【解析】试题分析:(1)根据装置图可知Pt(a)电极通入甲醇被氧化为CO2,所以Pt(a)是负极,电极反应式为CH3OH-6e—=CO2+6H+;Pt(b)电极是正极,反生还原反应,氧气得到电子。电极反应式为O2+4H++4e—=2H2O。
(2)根据以上分析可知总反应式为甲醇被氧气氧化为CO2和水,方程式为2CH3OH+3O2=2CO2+4H2O。
(3)根据负极电极反应式CH3OH-6e—=CO2+6H+可知如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有2mol÷6=1/3mol。

【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
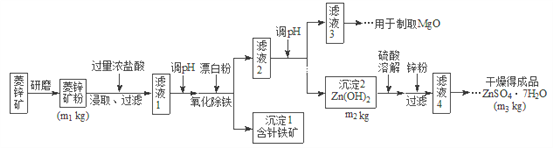
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示

