题目内容
(13分)X、Y、W、Q都是短周期元素,已知Y、X、W、Q的原子半径依次增大,X、Y 同周期,X、W 同主族,W 原子核内的质子数等于X、Y 原子核内的质子数之和,W 原子最外层电子数是Q 原子最外层电子数的3 倍。
(l)写出下列元素符号:X______,Y______,W______,Q________。
(2)W元素的单质有广泛用途,工业上制备该单质的化学方程式为:
______________________________________________________________________。
(3)Y元素的某种单质通大酸性淀粉碘化钾溶液中,溶液变蓝,同时生成Y元素的另一种单质,该反应的离子方程式为:
______________________________________________________________________。
(4)Y、W、Q三种元素可组成一种盐,其溶液中各离子的浓度从大到小的顺序为
______________________________________________________________________。
(l)写出下列元素符号:X______,Y______,W______,Q________。
(2)W元素的单质有广泛用途,工业上制备该单质的化学方程式为:
______________________________________________________________________。
(3)Y元素的某种单质通大酸性淀粉碘化钾溶液中,溶液变蓝,同时生成Y元素的另一种单质,该反应的离子方程式为:
______________________________________________________________________。
(4)Y、W、Q三种元素可组成一种盐,其溶液中各离子的浓度从大到小的顺序为
______________________________________________________________________。
⑴B ,O,Al,Na。(4分)
 ⑵2Al2O3
⑵2Al2O3  4Al + 3O2 (3分)
4Al + 3O2 (3分)
⑶2I-+ O3 + 2H+ I2 + H2O + O2 (3分)
I2 + H2O + O2 (3分)
⑷c(Na+) >c(AlO2-) >c(OH-)> c(H+) (3分)
 ⑵2Al2O3
⑵2Al2O3  4Al + 3O2 (3分)
4Al + 3O2 (3分)⑶2I-+ O3 + 2H+
 I2 + H2O + O2 (3分)
I2 + H2O + O2 (3分)⑷c(Na+) >c(AlO2-) >c(OH-)> c(H+) (3分)
(1)设X的质子数为x,则y的质子数为x +n,W的质子数为x + 8,因W的质子数=X的质子数+Y的质子数,故得:x + 8=2x +n,x=8-n,当n=1时,x=7,则Y为Ne,不符合题意;当n=2时,x=6,Y为Ne,不符合题意;当n=3时,x=5,则X为B、Y为O、W为Al,Q为Na,符合题意;当n=4时,x=4,则X为Be、Y为O、W为Mg,但不满足“W原子最外层电子数是Q原子最外层电子数的3倍”,不符合题意;同理可推得n=5、6、7时均不满足题意,故X为B、Y为O、W为Al、Q为Na。
(2)工业上是通过电解熔融Al2O3制备Al:2Al2O3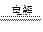 4Al + 3O2↑。
4Al + 3O2↑。
(3)氧元素的两种单质一般为O2、O3,由于O3的氧化能力大于O2,所以与KI淀粉溶液反应的是O3,根据题设条件参加反应的粒子为I―、O3、H+,生成的粒子为I2、O2、H2O,则有:I―+ O3+ H+ → I2 + O2 + H2O,配平该离子反应即得:2I―+ O3+ 2H+ → I2 + O2 + H2O。
(4)NaAlO2属于强碱弱酸盐,根据盐类水解规律可得其溶液中各种离子浓度大小顺序为:c(Na+)>c(AlO2―)>c(OH―)>c(H+)。
(2)工业上是通过电解熔融Al2O3制备Al:2Al2O3
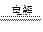 4Al + 3O2↑。
4Al + 3O2↑。(3)氧元素的两种单质一般为O2、O3,由于O3的氧化能力大于O2,所以与KI淀粉溶液反应的是O3,根据题设条件参加反应的粒子为I―、O3、H+,生成的粒子为I2、O2、H2O,则有:I―+ O3+ H+ → I2 + O2 + H2O,配平该离子反应即得:2I―+ O3+ 2H+ → I2 + O2 + H2O。
(4)NaAlO2属于强碱弱酸盐,根据盐类水解规律可得其溶液中各种离子浓度大小顺序为:c(Na+)>c(AlO2―)>c(OH―)>c(H+)。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是 ( )
( ) ( ) (4)
( ) (4) ( )
( )