题目内容
有A、B、C三种元素,其核电荷数之和为32,A为原子核内有12个中子的金属元素,形成化合物时显+2价,当2.4 g单质A与足量稀硫酸反应时,产生2.24 L H2(标准状况)。B有两个电子层,且各电子层的电子数与电子层总数相等。
(1)写出元素A、B、C的名称及元素符号:A_____,B_____,C_____。
(2)A2+、B、C2-的结构示意图分别是________,________,________。
(1)写出元素A、B、C的名称及元素符号:A_____,B_____,C_____。
(2)A2+、B、C2-的结构示意图分别是________,________,________。
(1)A:Mg B:Be C:S
(2)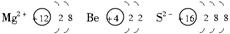
(2)
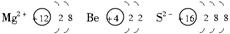
因为A+2H+ A2++H2↑
A2++H2↑
Mr(A)g 22.4 L
2.4g 2.24 L
 =
=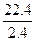
Mr(A)=24,即A原子的质量数为24,故A原子的质子数为(24-12)=12,即为Mg元素。依题意B原子的电子数为:(2+2)=4,即核电数为4,是Be元素,故C元素原子的核电荷数为(32-12-4)=16,故C为硫元素。
 A2++H2↑
A2++H2↑Mr(A)g 22.4 L
2.4g 2.24 L
 =
=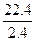
Mr(A)=24,即A原子的质量数为24,故A原子的质子数为(24-12)=12,即为Mg元素。依题意B原子的电子数为:(2+2)=4,即核电数为4,是Be元素,故C元素原子的核电荷数为(32-12-4)=16,故C为硫元素。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
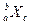 ,极易形成
,极易形成 ,下列说法不正确的是( )
,下列说法不正确的是( ) g
g