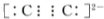题目内容
13.在下列物质:A.烧碱 B.硫酸 C.干冰 D.硫酸钡 E.纯碱 F.铁(1)既不是电解质,也不是非电解质的是F(或铁).
(2)纯碱的电离方程式是Na2CO3=2Na++CO32-.
(3)烧碱溶液与稀硫酸混合,发生反应的离子方程式为H++OH-=H2O.
(4)将干冰升华后所得的气体通入过量烧碱溶液中,发生反应的离子方程式为
CO2+2OH-=CO32-+H2O.
(5)a、b、c、d是Na2CO3、BaCl2、HCl、AgNO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
②写出a+c反应的离子方程式Ag++Cl-=AgCl↓.
盐酸分子式:HCl相对分子质量:36.5密度:1.19g/cm3质量分数:36.5%
分析 (1)电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子.电解质包括离子型或强极性共价型化合物;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物.也就是说,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子.非电解质包括弱极性或非极性共价型化合物;
单质,混合物既不是电解质也不是非电解质;
(2)纯碱是碳酸钠的简称,可根据电离方程式的书写规则进行分析;
(3)烧碱溶液与稀硫酸混合,反应的实质为氢离子与氢氧化根离子生成水;
(4)将干冰升华后所得的气体为二氧化碳,通入过量烧碱溶液中生成碳酸钠和水;
(5)AgNO3与其它三种物质反应均生成沉淀,则a为AgNO3,b与其它物质可生成沉淀、可生成气体,则b为HCl,所以d为Na2CO3,以此来解答.
解答 解:(1)A.烧碱是氢氧化钠,NaOH在水溶液里或在熔融状态下,能完全电离出自由移动的钠离子和氢氧根离子导致导电,所以NaOH是电解质;
B.硫酸在水溶液中能完全电离出氢离子和硫酸根离子是电解质;
C.干冰是二氧化碳,CO2在水溶液里,生成碳酸,碳酸能电离出自由移动的氢离子和碳酸根离子导致导电,不是二氧化碳自身电离,所以二氧化碳是非电解质;
D.硫酸钡属于盐,在熔融状态时,可以完全电离变成离子,属于电解质;
E.纯碱是碳酸钠,属于盐,在水溶液里或者熔融状态时,可以完全电离变成离子,属于电解质;
F.铁片能导电,是单质,它既不是电解质,也不是非电解质;
所以既不是电解质,也不是非电解质的是F(或铁),
故答案为:F(或铁);
(2)纯碱是碳酸钠的简称,碳酸钠在水中电离生成钠离子和碳酸根离子,Na2CO3=2Na++CO32-,故答案为:Na2CO3=2Na++CO32-;
(3)烧碱溶液与稀硫酸混合,反应的实质为氢离子与氢氧化根离子生成水,反应的离子方程式为H++OH-=H2O,故答案为:H++OH-=H2O;
(4)将干冰升华后所得的气体为二氧化碳,通入过量烧碱溶液中生成碳酸钠和水,反应的离子方程式CO2+2OH-=CO32-+H2O,
故答案为:CO2+2OH-=CO32-+H2O;
(5)①结合物质混合的现象及AgNO3与其它三种物质反应均生成沉淀,则a为AgNO3,b与其它物质可生成沉淀、可生成气体,则b为HCl,所以d为Na2CO3,则c为BaCl2,故答案为:HCl;
②a+c反应生成AgCl沉淀和硝酸,离子反应为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓.
点评 本题主要考查了电解质的概念、考查了物质的分类、考查了电离方程式的书写,注意相关知识的掌握,题目难度不大.

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案| A. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| B. | 工业上利用油脂生产肥皂、用淀粉酿酒、用纤维素生产酒精 | |
| C. | 酸性高锰酸钾紫色溶液中加入植物油充分振荡后,溶液颜色不会因反应褪去 | |
| D. | 蛋白质和油脂在发生腐败变质时,均会产生含NH3的刺激性气味 |
| 序号 | 事实 | 推论 |
| A | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| B | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,Br2+H2?2HBr K=5.6×107 I2+H2?2HI K=43 | 非金属性:Br>I |
| A. | A | B. | B | C. | C | D. | D |
| A. | 烧结粘土制陶瓷涉及化学变化 | |
| B. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| C. | 点燃爆竹后,硫燃烧生成SO3 | |
| D. | 服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒 |
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式C2H4+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:乙烯气相直接水合反应如下:
C2H4(g)+H2O(g)?C2H5OH(g) H=-45.5KJ/mol
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)

①计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=0.07(MPa)-1(Kp表示用平衡分压代替平衡浓度计算出的平衡常数的值,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为:p1<p2<p3<p4,理由是反应分子数减少,相同温度下,压强升高乙烯转化率提高.
(3)若某温度下,反应C2H4(g)+H2O(g)?C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示.
| 物质 | C2H4(g) | H2O(g) | C2H5OH(g) |
| 物质的量分数 | 0.25 | 0.25 | 0.5 |
| A. | 硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 在氢氧化钡溶液中逐滴加入硫酸氢钠溶液至恰好呈中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H-+H2O2═Fe3++2H2O | |
| D. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由C(石墨)→C(金刚石);△H=+73 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ |
| A. | NaOH的摩尔质量是40g | |
| B. | 1摩尔H2SO4质量为98g | |
| C. | 阿伏加德罗常数就是6.02×1023mol-1 | |
| D. | 1mol任何纯净物都含有相同的原子数 |