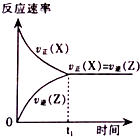
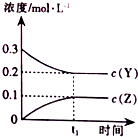
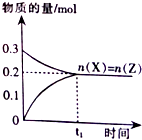
题目内容
1.相同体积的NaCl溶液(浓度为c1)和Na2SO4溶液(浓度为c2),若其中的Na+物质的量浓度相同,则它们的物质的量浓度c1和c2的关系是( )| A. | c1=c2 | B. | c1<c2 | C. | c1=2c2 | D. | 2c1=c2 |
分析 根据物质的构成来计算离子的浓度,再结合其中的Na+ 物质的量浓度相同来解答,离子难度浓度=溶质浓度×化学式中离子数.
解答 解:NaCl溶液(浓度为C1)中c(Na+)=C1,
Na2SO4溶液(浓度为C2)中c(Na+)=2×C2,
其中的Na+ 物质的量浓度相同,
则2×C2=C1,c1=2c2
故选C.
点评 本题考查物质的量浓度的有关计算,明确物质的构成及离子浓度的计算即可解答,较简单.

练习册系列答案
相关题目
11.很多餐馆使用的液化石油气主要成分是丁烷,在使用过程中,常有一些杂质以液态沉淀于钢瓶内,这些杂质是( )
| A. | 丙烷和丁烷 | B. | 乙烷和丙烷 | C. | 乙烷和丁烷 | D. | 戊烷和己烷 |
9.下列说法中正确的是( )
| A. | 1mol任何气体的体积都约为22.4L | |
| B. | 0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| C. | 在标准状况下,2mol酒精的体积约为44.8L | |
| D. | 常温常压下,质量为32g的O2含有的分子数为NA |
16.在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:
A(s)+2B(g)?C(g)+D(g) 已达到平衡状态( )
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量.
A(s)+2B(g)?C(g)+D(g) 已达到平衡状态( )
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量.
| A. | ②③⑤ | B. | ①②③ | C. | ②③④ | D. | ①③④⑤ |
6.下列与实验相关的叙述正确的是( )
| A. | Hg(NO3)2溶于水,可将含有Hg(NO3)2的废液倒入水池中,再用水冲入下水道 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,必须冷却至室温才能转移到容量瓶中 | |
| D. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯 |
13.X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法一定正确的是( )
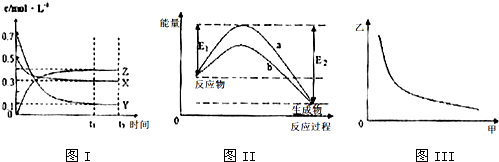

| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=E2-E1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线 |
10.蛋清的水溶液下列性质体现其是胶体的是( )
| A. | 能穿过滤纸 | B. | 烧焦产生焦羽毛气味 | ||
| C. | 具有丁达尔效应 | D. | 高于70℃发生变性 |
11.下列离子反应方程式正确的是( )
| A. | 钠和水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 过氧化钠与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 铁与足量稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸氢钠溶液与烧碱溶液反应:NaHCO3+OH-═Na++CO32-+H2O |