题目内容
实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O来快速制取氯气。
(1)请标出电子的转移方向和数目
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)若产生标准状况下Cl2 11.2L,则反应过程中转移的电子数为________ ,被氧化的还原剂
的物质的量为___________。
(3)需消耗36.5%的浓盐酸多少质量?
(1) (2分)
(2分)
(2)6.02×1023或NA;1mol (每空2分) (3)160g(4分)
解析试题分析:(1)依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;锰元素化合价从+7价降低到+2价,得到5个电子;氯元素化合价从-1价升高为0价,失去1个电子,所以双线桥表示为: ;
;
(2)依据化学方程式和元素化合价变化判断电子转移,计算被氧化的物质的量;2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。若生成标准状况下11.2L 氯气,物质的量=11.2L÷22.4L/mol=0.5mol;生成5molCl2,转移电子为10mol,所以生成0.5mol氯气转移转移电子为1mol,其个数是6.02×1023或NA;16molHCl反应,其中被氧化的HCl为10mol;生成氯气物质的量为5mol,所以0.5mol氯气生成,被氧化的HCl为1mol。
(3)参加反应的氯化氢的物质的量是1.6mol
其质量=1.6mol×363.5g/mol
所以需消耗36.5%的浓盐酸的质量为1.6mol×363.5g/mol÷36.5%=160g
考点:考查氧化还原反应方程式配平、计算以及质量百分比浓度的计算

高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(l)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO42-+_______ H2O="_______" Fe(OH)3(胶体)+_______O2↑+_______OH-。
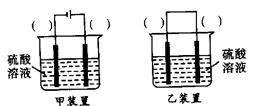
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为________。

(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为________ 。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究过氧化氢的性质。
请填写下列空白:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。 MnO4-+
MnO4-+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ O2+
O2+
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。
如何判断滴定到达终点:
。
(4)如图表示25 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)________。
| A.是a mL | B.是(25-a)mL | C.一定大于a mL | D.一定大于(25-a)mL |
(6)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”或“偏低”或“不变”)。
 2Cu+SO2
2Cu+SO2