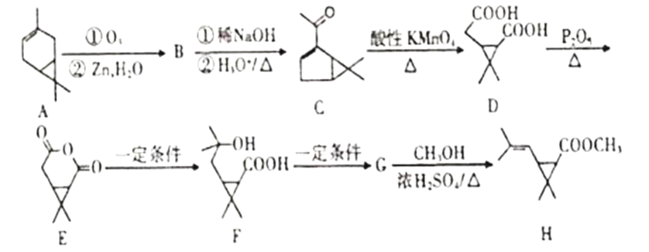
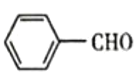
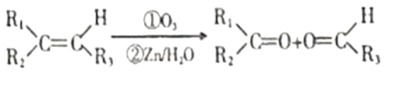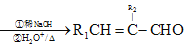题目内容
【题目】(1)比较给出H+的能力的相对强弱:H2CO3___C6H5OH(填“>”、“<”或“=”);用一个离子方程式说明CO32和C6H5O结合H+能力的相对强弱___。
(2)Ca(CN)2是离子化合物,各原子均满足8电子稳定结构。写出Ca(CN)2的电子式___。
(3)常压下,水晶的硬度比晶体硅的硬度大,其主要原因是___。
【答案】> C6H5OH+CO32-=HCO3-+C6H5O- ![]() 或
或![]() 两者都为原子晶体,氧原子半径比硅原子半径小,水晶中Si-O键比晶体硅中Si—Si更牢固
两者都为原子晶体,氧原子半径比硅原子半径小,水晶中Si-O键比晶体硅中Si—Si更牢固
【解析】
(1)H2CO3中羟基氢比乙醇中的羟基氢活泼,则H2CO3给出H+的能力比乙醇要强,由反应C6H5OH+CO32-=HCO3-+C6H5O-可说明CO32强于C6H5O结合H+能力,故答案为:>;C6H5OH+CO32-=HCO3-+C6H5O-;
(2)Ca核外电子为:2、8、8、2,失去两个电子为Ca2+;C最外层4个电子,碳原子和氮原子共用3电子对,一个碳周围就有7个电子,得到2电子达稳定结构,所以Ca(CN)2的电子式为![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(3)水晶的主要成分是SiO2,晶体硅是硅单质,因为两者都为原子晶体,氧原子半径比硅原子半径小,所以水晶中Si-O键比晶体硅中Si—Si更牢固,水晶硬度更大,故答案为:两者都为原子晶体,氧原子半径比硅原子半径小,石英中Si-O键比晶体硅中Si—Si更牢固。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目