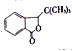
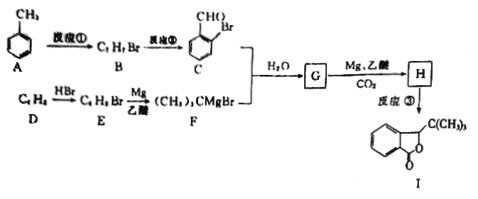
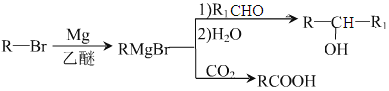
题目内容
【题目】某有机样品3.1 g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重 7. lg,经过滤得到10g沉淀。该有机样品可能是
A. 甲醇 B. 乙醇 C. 丙三醇 D. 甲醇和丙三醇的混合物
【答案】D
【解析】l0g沉淀为CaCO3,物质的量为![]() =0.1mol,根据碳元素守恒可知,产生的二氧化碳为0.1mol,二氧化碳的质量为0.1mol×44g/mol=4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1-4.4=2.7g,其物质的量为
=0.1mol,根据碳元素守恒可知,产生的二氧化碳为0.1mol,二氧化碳的质量为0.1mol×44g/mol=4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1-4.4=2.7g,其物质的量为![]() =0.15mol,氢元素质量为0.3mol×1g/mol=0.3g,有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,氧原子物质的量为:
=0.15mol,氢元素质量为0.3mol×1g/mol=0.3g,有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,氧原子物质的量为: ![]() =0.1mol,即3.1g有机物中n(C)=0.1mol,n(H)=0.15mol×2=0.3mol,n(O)=0.1mol,碳、氢、氧原子的物质的量之比为0.1mol:0.3mol:0.1mol=1:3:1,即最简式为CH3O,乙二醇分子式为C2H6O2,符合题意,甲醇和丙三醇按1︰1混合时其平均分子式为C2H6O2,也符合题意,故选D。
=0.1mol,即3.1g有机物中n(C)=0.1mol,n(H)=0.15mol×2=0.3mol,n(O)=0.1mol,碳、氢、氧原子的物质的量之比为0.1mol:0.3mol:0.1mol=1:3:1,即最简式为CH3O,乙二醇分子式为C2H6O2,符合题意,甲醇和丙三醇按1︰1混合时其平均分子式为C2H6O2,也符合题意,故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气。将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是
选项 | X溶液 | 现象 |
|
A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
D | 紫色石蕊溶液 | 溶液先变红后褪色 |
A. A B. B C. C D. D