题目内容
【题目】某同学用沉淀法测定Na2SO3和NaCl固体混合物中Na2SO3的质量分数.操作流程如下: 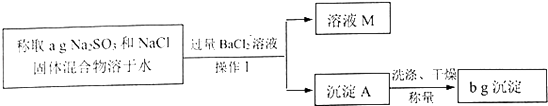
(1)操作I所用到的玻璃仪器有烧杯、玻璃棒、 .
(2)操作I之前,为判断所加BaCl2溶液是否过量,设计如下方案,其中最合理的是 .
A.取少量上层清液,继续滴加稀H2SO4 , 若沉淀产生则说明BaCl2已过量
B.待浊液澄清后,继续滴加BaCl2溶液,若无沉淀产生则说明BaCl2已过量
C.待浊液澄清后,继续滴加稀H2SO4 , 若沉淀产生则说明BaCl2已过量
(3)根据操作流程中的数据计算Na2SO3的质量分数 .
(4)该同学认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因 .
【答案】
(1)漏斗
(2)B
(3)![]() ×100%
×100%
(4)Na2SO3已部分被空气中的氧气氧化
【解析】解:用沉淀法测定Na2SO3的质量分数,由实验流程可知,加过量氯化钡生成亚硫酸钡沉淀,操作I为过滤,沉淀A为BaSO3 , 若变质混有硫酸钡,洗涤、干燥后称量沉淀质量即可测定质量分数,(1)由上述分析可知,操作Ⅰ为过滤操作,需要用到的玻璃仪器有烧杯、玻璃棒、漏斗,所以答案是:漏斗;(2)判断是否过量,主要看溶液中是否还有SO32﹣ , 因此将溶液静置,向上层清液中继续滴加BaCl2溶液,若无沉淀说明BaCl2溶液已过量,沉淀完全,
所以答案是:B;(3)沉淀A为BaSO3 , 物质的量为 ![]() mol,由S原子守恒可知,Na2SO3的质量为
mol,由S原子守恒可知,Na2SO3的质量为 ![]() g,则Na2SO3的质量分数为
g,则Na2SO3的质量分数为 ![]() ×100%,
×100%,
所以答案是: ![]() ×100%;(4)发现实验结果与预期相差较大,可能Na2SO3变质,验证方法为取少量试样于试管中配成溶液,先滴加适量稀盐酸,再滴加BaCl2溶液,若有白色沉淀生成,则证明该Na2SO3变质,
×100%;(4)发现实验结果与预期相差较大,可能Na2SO3变质,验证方法为取少量试样于试管中配成溶液,先滴加适量稀盐酸,再滴加BaCl2溶液,若有白色沉淀生成,则证明该Na2SO3变质,
所以答案是:Na2SO3已部分被空气中的氧气氧化;

 阅读快车系列答案
阅读快车系列答案