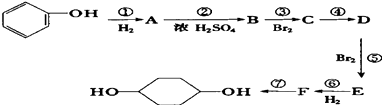
题目内容
【题目】在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( ) 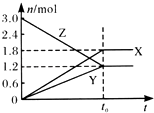
A.该反应的化学方程式为:3Z═3X+2Y
B.t0时,X、Y、Z的质量不再改变
C.t0时,Z的浓度为1.2 mol/L
D.t0时,反应停止,反应速率为0
【答案】B
【解析】解:A、由图可知,X、Y的物质的量增大,为生成物,Z物质的量减小,为反应物,到平衡后,X生成1.8mol,Y生成1.2mol,Z反应1.8mol,X、Y、Z的化学计量数之比=1.8:1.2:1.8=3:2:3,则反应的化学方程式为:3Z3X+2Y,是可逆反应,故A错误; B、化学平衡时各组分的浓度不再随时间变化而变化,故X、Y、Z的质量也不再改变,故B正确;
C、根据图像可知平衡时Z的浓度为 ![]() =0.6mol/L,故C错误;
=0.6mol/L,故C错误;
D、根据可逆反应平衡的特征可知,反应处于平衡时正逆反应速率相等,但不等于零,故D错误;
故选B.
【考点精析】关于本题考查的化学平衡状态本质及特征,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能得出正确答案.

【题目】甲、乙两化学兴趣小组安装两套如图1相同装置,用以探究影响H2O2分解速率的因素. 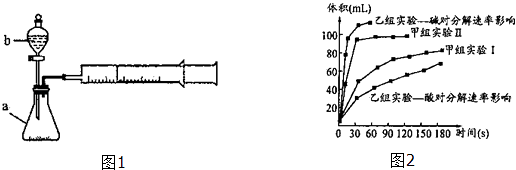
(1)仪器b的名称: .
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
甲组实验Ⅰ | 做实验参照 | 25 | 10mL 2%H2O2 | |
甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10mL 5%H2O2 |
(3)甲、乙两小组得出如图2数据. ①由甲组实验得出的数据可知:浓度越大,H2O2分解速率(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2 , 其化学反应方程式为;支持这一方案的理由是 .