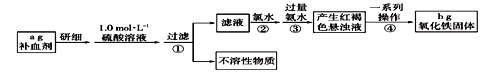
题目内容
【题目】铬为高效催化剂的主要成分元素,从铬铁矿[主要含Ag2S、Cu2(OH)2CO3、FeO、Cr2O3、SiO2]中提取Cr、Ag的工艺流程如图:
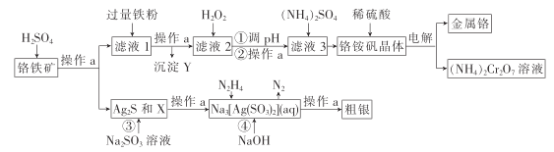
已知:①部分阳离子以氢氧化物开始沉淀和完全沉淀的pH如下表(金属离子浓度为0.01mol·L-1)
沉淀物 | Fe(OH)2 | Fe(OH)3 | Cr(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 4.9 |
开始沉淀的pH | 9.6 | 3.7 | 6.8 |
②铬铵矾晶体:[NH4Cr(SO4)2·12H2O]
(1)操作a为___;X和Y分别为____、___。
(2)写出加入H2O2发生反应的离子方程式:___。
(3)调节pH值可用的物质的化学式为___,pH值应当控制的范围为__;由滤液3获得铬酸铵晶体的正确操作方法是___、过滤、洗涤、干燥。
(4)将铬铵矾晶体溶于硫酸而不是直接溶于水的主要原因是___。
(5)步骤④发生反应的离子方程式为___。
【答案】过滤 SiO2 Cu、Fe 2Fe2++H2O2+2H+=2Fe3++2H2O Cr2(CO3)3或Cr2O3 3.7~4.9 蒸发浓缩、冷却结晶 防止硫酸铬铵水解 4[Ag(SO3)2]3-+N2H4+4OH-=4Ag↓+8SO32-+N2↑+4H2O
【解析】
铬铁矿中加入硫酸,其中金属氧化物和Cu2(OH)2CO3溶于酸转变成硫酸盐,硫化银和二氧化硅不溶于硫酸,过滤分离,滤液1中加入足量铁粉除去铜离子,滤液2加过氧化氢氧化亚铁离子,调节pH值沉淀除去铁离子,再加硫酸铵生成铬铵矾晶体[NH4Cr(SO4)2·12H2O],电解得到金属铬和重铬酸铵;硫化银和二氧化硅中加入亚硫酸钠将硫化银转变成可溶性盐{Na3[Ag(SO3)2]},在Na3[Ag(SO3)2]溶液中再加入肼和氢氧化钠得到银单质,据此分析解答。
(1)由得到滤液和滤渣可知,操作a为过滤;二氧化硅不与硫酸反应,故X为二氧化硅;Cu2(OH)2CO3溶于硫酸生成铜离子,由工艺流程的目的可以推知加入过量铁粉的目的是除去杂质铜离子,得出的Y为Cu和剩余的Fe,故答案为:过滤;SiO2;Cu、Fe;
(2)过氧化氢能够将亚铁离子氧化为铁离子,利于后续除去,反应的离子反应为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)加入的物质能与酸反应,同时不能带入新的杂质离子;调节pH的范围,需要使铁离子沉淀完全,但不能使三价铬离子沉淀,根据部分阳离子以氢氧化物开始沉淀和完全沉淀的pH表,pH的范围为3.7~4.9;从溶液中得到晶体,首先加热浓缩,然后降温得到晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:Cr2(CO3)3或Cr2O3;3.7~4.9;蒸发浓缩、冷却结晶;
(4)铬铵矾能够发生水解,加酸可以抑制其水解,因此将铬铵矾晶体溶于硫酸而不是直接溶于水,故答案为:防止硫酸铬铵水解;
(5)根据流程信息可知反应物为[Ag(SO3)2]3-、N2H4、OH-,生成的产物有Ag和N2↑,同时还应该生成SO32-,结合化合价升降法配平得到该反应的方程式为:4[Ag(SO3)2]3-+N2H4+4OH-=4Ag↓+8SO32-+N2↑+4H2O,故答案为:4[Ag(SO3)2]3-+N2H4+4OH-=4Ag↓+8SO32-+N2↑+4H2O。