��Ŀ����
����Ŀ���������岻��ȱ�ٵ���Ԫ�أ�������������(FeSO4��7H2O)��ҽ���ϳ�������Ѫ����ij����С��Ϊ�ⶨ�ò�Ѫ������Ԫ�صĺ������������ʵ�顣
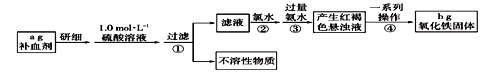
(1)ʵ��ʱ��18.4 mol��L-1��Ũ��������100mL1.0 mol��L-1��������Һ������Ũ��������Ϊ______mL������һλС������
(2)����ٹ��˺����Һ�м�����ˮ������Ӧ�����ӷ���ʽΪ__________________________��
(3)����Һ��ֱ�Ӽ��������ˮʱ�����ɵİ�ɫ����Ѹ�ٱ�Ϊ����ɫ������Ϊ���ɫ��������ɫ�仯��ԭ���û�ѧ����ʽ��ʾΪ_______________________��
(4)�ò�Ѫ������Ԫ�ص���������Ϊ____________��������ۼ��백ˮ�������㣬��ʵ����_____���ƫ����ƫС��������Ӱ�족��
(5)��ѧ�о��������ú����������IJ�Ѫ��ʱ��ͬʱ����ά����C��������Ԫ�ص����ա���ά����C��������е�������_________________��
���𰸡�5.4 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ![]() ��100% ƫС ��ԭ��
��100% ƫС ��ԭ��
��������
������ͼ��֪����ʵ��ԭ��Ϊ����ҩƷ�е�Fe2+�γ���Һ����Fe2+����ΪFe3+��ʹFe3+ת��Ϊ����������������ת��Ϊ��������ͨ���ⶨ�����������������㲹Ѫ������Ԫ�صĺ�����
(1)����Ũ������ϡ��ǰ�����ʵ����ʵ������ֲ�����ʽ���㣻
(2)������ˮ������������Ϊ�����ӣ�
(3)����Һ��ֱ�Ӽ��������ˮʱ�����ɵİ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��������ɫ�仯�����������������������������������������Ĺ��̣�
(4)��Ԫ���غ�������㣬������ۼ��백ˮ�������㣬�����Ӳ���ȫ���������ⶨ��Ԫ�غ���ƫС��
(5)����ά����C����ʹʳ���е������ӻ�ԭ���������ӣ��������������ա�
(1)Ũ������ϡ��ǰ�����ʵ����ʵ������ֲ��䣬������Ũ�������ΪV����100mL��10-3��1mol/L=18.4mol/L��V�����V=5.4mL��
(2)����ٹ��˺�������Һ�м��������ˮ����Ϊ������Fe2+��������Ӧ�����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl-��
(3)����Һ��ֱ�Ӽ��������ˮʱ�����ɵİ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��������ɫ�仯�Ļ�ѧ����ʽ��4Fe(OH)2+O2+2H2O=4Fe(OH)3��
(4)���̷�����֪���õ�����������Ϊbg��������Ԫ���غ�õ�������������=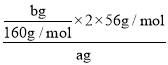 ��100%=
��100%=![]() %��������ۼ��백ˮ�������㣬�����Ӳ���ȫ���γɳ�������ⶨ��Ԫ����������ƫС��
%��������ۼ��백ˮ�������㣬�����Ӳ���ȫ���γɳ�������ⶨ��Ԫ����������ƫС��
(5)ά����C�л�ԭ�ԣ��ܷ���ά����C����ʹʳ���е������ӻ�ԭ���������ӣ��������������ա�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����Ϊ��Ч��������Ҫ�ɷ�Ԫ�أ��Ӹ�����[��Ҫ��Ag2S��Cu2(OH)2CO3��FeO��Cr2O3��SiO2]����ȡCr��Ag�Ĺ���������ͼ��
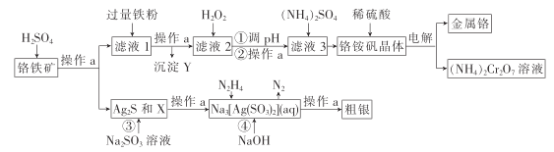
��֪���ٲ������������������↑ʼ��������ȫ������pH���±�(��������Ũ��Ϊ0.01mol��L-1)
������ | Fe(OH)2 | Fe(OH)3 | Cr(OH)3 |
��ʼ������pH | 7.6 | 2.7 | 4.9 |
��ʼ������pH | 9.6 | 3.7 | 6.8 |
�ڸ�立����壺[NH4Cr(SO4)2��12H2O]
��1������aΪ___��X��Y�ֱ�Ϊ____��___��
��2��д������H2O2������Ӧ�����ӷ���ʽ��___��
��3������pHֵ���õ����ʵĻ�ѧʽΪ___��pHֵӦ�����Ƶķ�ΧΪ__������Һ3��ø���茶������ȷ����������___�����ˡ�ϴ�ӡ����
��4������立������������������ֱ������ˮ����Ҫԭ����___��
��5������ܷ�����Ӧ�����ӷ���ʽΪ___��