题目内容
氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2)0.1 mol
Mn2++Cl2↑+2H2O(2)0.1 mol
(3)产生红棕色的烟;2Fe3++SO32-+H2O=2Fe2++SO42-+2H+; SO42-+Ba2+=BaSO4↓
 Mn2++Cl2↑+2H2O(2)0.1 mol
Mn2++Cl2↑+2H2O(2)0.1 mol(3)产生红棕色的烟;2Fe3++SO32-+H2O=2Fe2++SO42-+2H+; SO42-+Ba2+=BaSO4↓
试题分析:(1)实验室中常用二氧化锰和浓盐酸在加热条件下制取氯气,生成二氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;(2)实验室利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,根据价态归中规律知,KClO3中氯元素化合价由+5价变为0价,HCl中氯元素化合价由-1价变为0价,生成3mol Cl2转移5mol电子,标准状况下1.344 L氯气的物质的量为0.06mol,反应过程中转移电子的物质的量为0.1 mol;
(3)铁丝在氯气中燃烧发生反应3Cl2 +2Fe
 2FeCl3,FeCl3固体为棕色,现象为产生红棕色的烟;氯化铁溶液与亚硫酸钠溶液反应,Fe3+被还原为Fe2+,SO32-转化为SO42-,离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+; SO42-+Ba2+=BaSO4↓。
2FeCl3,FeCl3固体为棕色,现象为产生红棕色的烟;氯化铁溶液与亚硫酸钠溶液反应,Fe3+被还原为Fe2+,SO32-转化为SO42-,离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+; SO42-+Ba2+=BaSO4↓。
练习册系列答案
相关题目
 5CaCl2 + Ca(ClO3)2 + 6H2O
5CaCl2 + Ca(ClO3)2 + 6H2O
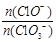 = 。
= 。