题目内容
某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应的过程中放出热量。温度较高时,氯气和碱还能发生如下反应:6Cl2 + 6Ca(OH)2 5CaCl2 + Ca(ClO3)2 + 6H2O
5CaCl2 + Ca(ClO3)2 + 6H2O
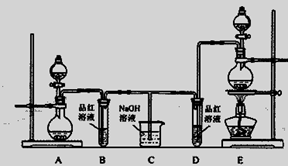
该兴趣小组设计了下列实验装置,进行实验。

甲 乙 丙 丁
请回答下列问题:
(1)①甲装置中发生反应的化学方程式是 。
②乙装置中的试剂是 ,作用是 。
③该兴趣小组用300mL 12mol/L盐酸与17.4g MnO2制备氯气,并将所得氯气与过量的石灰乳反应。则理论上最多可制得标况下氯气 L,Ca(ClO)2 g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO—、ClO3— 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
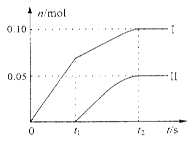
①图中曲线Ⅱ表示 离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为 mol。
③另取一份与②等物质的量Ca(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl—的物质的量为0.35mol,则产物中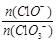 = 。
= 。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应的过程中放出热量。温度较高时,氯气和碱还能发生如下反应:6Cl2 + 6Ca(OH)2
 5CaCl2 + Ca(ClO3)2 + 6H2O
5CaCl2 + Ca(ClO3)2 + 6H2O该兴趣小组设计了下列实验装置,进行实验。

甲 乙 丙 丁
请回答下列问题:
(1)①甲装置中发生反应的化学方程式是 。
②乙装置中的试剂是 ,作用是 。
③该兴趣小组用300mL 12mol/L盐酸与17.4g MnO2制备氯气,并将所得氯气与过量的石灰乳反应。则理论上最多可制得标况下氯气 L,Ca(ClO)2 g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO—、ClO3— 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。

①图中曲线Ⅱ表示 离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为 mol。
③另取一份与②等物质的量Ca(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl—的物质的量为0.35mol,则产物中
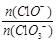 = 。
= 。(1)①4HCl (浓) + MnO 2 MnCl2 + C12↑ + 2H2O;
MnCl2 + C12↑ + 2H2O;
②饱和食盐水; 除去氯气中混有的氯化氢;
③4.48; 14.3;
(2)① ClO3— ②0.25 ③ 2:1
 MnCl2 + C12↑ + 2H2O;
MnCl2 + C12↑ + 2H2O;②饱和食盐水; 除去氯气中混有的氯化氢;
③4.48; 14.3;
(2)① ClO3— ②0.25 ③ 2:1
试题分析:(1)①MnO 2具有强氧化性,能将浓HCl中的Cl—氧化为C12,同时本身被还原为Mn2+。②浓盐酸具有挥发性,制得的C12中混有HCl,HCl极易溶于水,为了减少C12的溶解,用饱和食盐水除去。③根据方程式:4HCl (浓) + MnO 2
 MnCl2 + C12↑ + 2H2O,300mL 12mol/L盐酸与17.4g MnO2反应,盐酸过量,用二氧化锰计算可得V(Cl2)=4.48L;再根据反应:6Cl2 + 6Ca(OH)2
MnCl2 + C12↑ + 2H2O,300mL 12mol/L盐酸与17.4g MnO2反应,盐酸过量,用二氧化锰计算可得V(Cl2)=4.48L;再根据反应:6Cl2 + 6Ca(OH)2 5CaCl2 + Ca(ClO3)2 + 6H2O可得生成m[Ca(ClO)2]="14.3g" 。(2)①氯气和碱开始反应时温度较低,没有Ca(ClO3)2生成,反应的过程中放出热量,温度升高生成了Ca(ClO3)2 。 ②图像显示当Ca(OH)2完全反应后,生成ClO3—0.05 mol,生成ClO—0.1mol,根据关系式:6Ca(OH)2~2ClO3—和Ca(OH)2~Cl O—可得消耗石灰乳0.25 mol;③设生成ClO— amol 、生成ClO3— bmol ,根据电子守恒a +5b=0.35;无论生成CaCl2、Ca(ClO)2还是Ca(ClO3)2,氯原子都是钙的2倍,根据原子守恒可得:a +b +0.35=0.25×2;联立两个守恒可得a =0.1, b=0.05。
5CaCl2 + Ca(ClO3)2 + 6H2O可得生成m[Ca(ClO)2]="14.3g" 。(2)①氯气和碱开始反应时温度较低,没有Ca(ClO3)2生成,反应的过程中放出热量,温度升高生成了Ca(ClO3)2 。 ②图像显示当Ca(OH)2完全反应后,生成ClO3—0.05 mol,生成ClO—0.1mol,根据关系式:6Ca(OH)2~2ClO3—和Ca(OH)2~Cl O—可得消耗石灰乳0.25 mol;③设生成ClO— amol 、生成ClO3— bmol ,根据电子守恒a +5b=0.35;无论生成CaCl2、Ca(ClO)2还是Ca(ClO3)2,氯原子都是钙的2倍,根据原子守恒可得:a +b +0.35=0.25×2;联立两个守恒可得a =0.1, b=0.05。
练习册系列答案
相关题目
 MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是