题目内容
【题目】.下表是从实验中测得的不同物质中氧氧键的键长和键能数据:
氧氧键 |
|
|
|
|
键长 | 149 | 128 | 121 | 112 |
键能 |
|
|
|
|
其中![]() 、
、![]() 的值尚未测定,但可根据规律推导
的值尚未测定,但可根据规律推导![]() 、
、![]() 、
、![]() 、
、![]() 的大小顺序是
的大小顺序是![]() ,该规律是( )
,该规律是( )
A.成键时,电子数越多,键能越大
B.键长越短,键能越大
C.成键所用电子数越少,键能越大
D.成键时电子对越偏移,键能越大
【答案】B
【解析】
根据表中数据以及题目信息键能大小的顺序是b>a>y>x,可知键长越短,键能越大;根据O22-和O2成键所用电子数越少分别为1、2个;O2和O2+电子数分别为16、15。
A.O2和O2+电子数分别为16、15,但键能分别为:494kJ/mol、628kJ/mol,电子数越多键能越小,故A错误;
B.表中数据以及题目信息键能大小的顺序是b>a>y>x,可知键长越短,键能越大,故B正确;
C.O22和O2成键所用电子数分别为1、2个,键能:a>x,成键所用电子数越少,键能越小,故C错误;
D. 电子对偏移程度与键能无关,故D错误;
答案选B。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在一定条件下通过以下反应制得:2NO+Cl2=2ClNO,已知几种化学键的键能数据如下表所示:
化学键 | Cl-Cl | Cl-N | N=O | N=O(NO) |
键能(kJ·mol-1) | 243 | a | 607 | 630 |
请根据表中数据计算:2NO(g)+Cl2(g)=2ClNO(g)△H=___kJmol-1。
(2)温度一定时,在一个体积为1L的密闭容器中通入2molNO和1molCl2,10min时ClNO体积占气体总体积40%(气体的“体积分数”即“物质的量分数”),则反应开始到10min内NO的平均反应速率:v(NO)=___mol·L-1·min-1
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物,
主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
①△H1=___。
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是___(填序号)
a.<850℃ b.900~1000℃ c.>1050℃
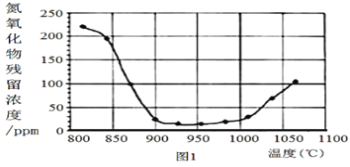
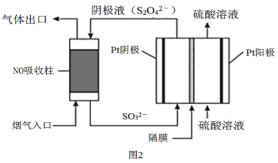
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为___。
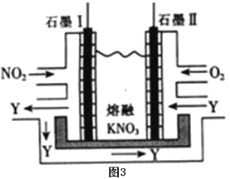
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图3所示,电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅰ附近发生的电极反应式为:___。
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子的杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A |
|
| 直线形 | 直线形 |
B |
|
| 平面三角形 | 三角锥形 |
C |
|
| 四面体形 | 平面三角形 |
D |
|
| 四面体形 | 正四面体形 |
A.AB.BC.CD.D
【题目】已知某些共价键的键能如表所示,试回答下列问题:℃
共价键 | 键能 | 共价键 | 键能 |
| 436 |
| 467 |
| 243 |
| 945 |
| 413 |
| 431 |
(1)![]() 键的键能为什么比
键的键能为什么比![]() 键的键能大_______?
键的键能大_______?
(2)已知![]() 在
在![]() 时有
时有![]() 的分子分解,而
的分子分解,而![]() 在
在![]() 时可能完全分解为
时可能完全分解为![]() 和
和![]() ,试解释其中的原因_______。
,试解释其中的原因_______。
(3)试解释氮气能在空气中稳定存在的原因_______。
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表前四周期中的四种常见元素,其相关信息如下表:
是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素代号 | 相关信息 |
|
|
| 常温常压下, |
|
|
|
|
(1)![]() 位于元素周期表第__________周期第__________族。
位于元素周期表第__________周期第__________族。
(2)![]() 是一种常用的溶剂,
是一种常用的溶剂,![]() 的分子中存在个
的分子中存在个![]() 键。在
键。在![]() 、
、![]() 两种共价键中,键的极性较强的是_____________,键长较长的是___________。
两种共价键中,键的极性较强的是_____________,键长较长的是___________。
(3)写出![]() 元素的原子核外电子排布式:__________。
元素的原子核外电子排布式:__________。