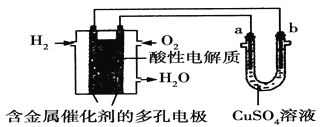
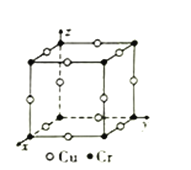
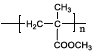
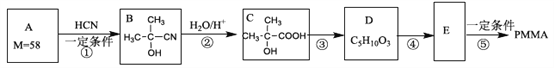
题目内容
【题目】已知草酸为二元弱酸,在25℃时,草酸的两步电离常数为:Ka1=5.0×10-2,Ka2=m。实验测得在该温度下改变0.1mol·L-1的H2C2O4溶液的pH值时,溶液中主要微粒的物质的量分数δ(X)随pH值的变化如图所示[已知:①δ(H2C2O4)=  ②1g5=0.7;③图中b点对应的pH值为2.7]。则下列说法不正确的是( )
②1g5=0.7;③图中b点对应的pH值为2.7]。则下列说法不正确的是( )
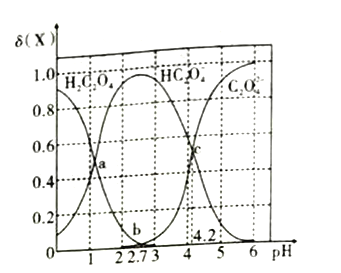
A. 在a点,溶液对应的pH值为1.3 B. pH=2.8时,c(HC2O4-)>c(C2O42-)+c(H2C2O4)
C. pH=4.2时,c(HC2O4-)=c(C2O42-)=c(H+) D. lgKa2=-4.2
【答案】C
【解析】A. 在a点时,c(HC2O4-)=c(H2C2O4),Ka1=5.0×10-2=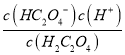 = c(H+),溶液对应的pH=-lg c(H+)=-lg 5.0×10-2=1.3,故A正确;B. 根据图像,pH=2.8时,溶质主要为HC2O4-,c(HC2O4-)>c(C2O42-)+c(H2C2O4),故B正确;C. pH=4.2时,c(HC2O4-)=c(C2O42-)=0.05mol·L-1,此时c(H+)=10-4.2 mol·L-1,c(HC2O4-)=c(C2O42-)>c(H+),故C错误;D. pH=4.2时,c(HC2O4-)=c(C2O42-),则lgKa2=lg
= c(H+),溶液对应的pH=-lg c(H+)=-lg 5.0×10-2=1.3,故A正确;B. 根据图像,pH=2.8时,溶质主要为HC2O4-,c(HC2O4-)>c(C2O42-)+c(H2C2O4),故B正确;C. pH=4.2时,c(HC2O4-)=c(C2O42-)=0.05mol·L-1,此时c(H+)=10-4.2 mol·L-1,c(HC2O4-)=c(C2O42-)>c(H+),故C错误;D. pH=4.2时,c(HC2O4-)=c(C2O42-),则lgKa2=lg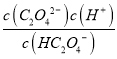 = lg c(H+)=-4.2,故D正确;故选C。
= lg c(H+)=-4.2,故D正确;故选C。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示,下列说法不正确的是 ( )
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A. 盐酸的物质的量浓度为3.0 mol·L-1 B. 根据表中数据能计算出混合物中NaHCO3的质量分数
C. 加入9.2g固体混合物时盐酸过量 D. 15.7g固体混合物恰好与盐酸完全反应