题目内容
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
(2)镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的稀硫酸),电池总反应为:Mg+H2O2+H2SO4= MgSO4 +2H2O。该电池工作时,正极发生的电极反应式为: 。此时,正极周围海水的pH: (填:增大、减小或不变)
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O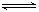
 Al(OH)4-+ H+ ②NH3+H2O
Al(OH)4-+ H+ ②NH3+H2O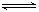 NH4+ + OH-
NH4+ + OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式 。
(B)已知N2H4是二元弱碱,试写出其第二步电离方程式 。
 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。(2)镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的稀硫酸),电池总反应为:Mg+H2O2+H2SO4= MgSO4 +2H2O。该电池工作时,正极发生的电极反应式为: 。此时,正极周围海水的pH: (填:增大、减小或不变)
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O
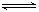
 Al(OH)4-+ H+ ②NH3+H2O
Al(OH)4-+ H+ ②NH3+H2O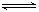 NH4+ + OH-
NH4+ + OH-(A)已知B(OH)3是一元弱酸,试写出其电离方程式 。
(B)已知N2H4是二元弱碱,试写出其第二步电离方程式 。
(1)NO; 4.8g (每空2分)(2)H2O2+2H++2e-=2H2O ;增大(每空2分)
(3)B(OH)3+H2O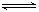 B(OH)4- + H+ ; N2H5+ +H2O
B(OH)4- + H+ ; N2H5+ +H2O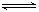 N2H62+ + OH-
N2H62+ + OH-
(3)B(OH)3+H2O
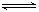 B(OH)4- + H+ ; N2H5+ +H2O
B(OH)4- + H+ ; N2H5+ +H2O N2H62+ + OH-
N2H62+ + OH-略

练习册系列答案
相关题目

 Fe2++2e-
Fe2++2e- 2PbSO4+2H2O据此判断下列叙述
2PbSO4+2H2O据此判断下列叙述 PbSO4+2H2O
PbSO4+2H2O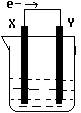
 方式插入同浓度的稀硫酸中一段时间,叙述正确的是
方式插入同浓度的稀硫酸中一段时间,叙述正确的是