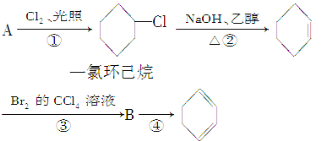
题目内容
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为_________。
(2)N2O在金粉表面发生热分解反应:2N2O(g) =2N2(g)+O2(g) △H。
已知:2NH3(g) + 3N2O(g) = 4N2(g) + 3 H2O(l) △H1
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(l) △H2
△H= _________(用含△H1、△H2的代数式表示)。
(3)N2O和CO是环境污染性气体,这两种气体会发生反应:N2O(g)+CO)(g)CO2(g)十N2(g),“Fe+”常用作该反应的催化剂。 其总反应分两步进行:
第一步为Fe+ +N2OFeO+ +N2;第二步为________(写化学方程式)。
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应活化能_______ (填“大于”“小于”或“等于”)第一步反应活化能。
(4)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:

①该反应的△H________(填“>”或“<”)0。
②容器Ⅱ的体积为5L,在470℃下进行反应,30s后达到平衡,0~30s内容器Ⅱ中O2的反应速率为_________mol.L-1.min-1 ;容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率:![]() 正(N2O)_______
正(N2O)_______![]() 逆(N2O)。(填“>”“<”或“=”)
逆(N2O)。(填“>”“<”或“=”)
③图中A、B、C三点处容器内密度最大的点是_________(填“A”“B”或“C”)。
④已知容器Ⅰ的体积为10L,370℃时,该反应的平衡常数k=__________。
【答案】2NH3 +2O2 N2O + 3H2O
N2O + 3H2O ![]() △H1 —
△H1 —![]() △H2 FeO+ +COFe+ +CO2 小于 > 0.012 < C 8.9×10-4
△H2 FeO+ +COFe+ +CO2 小于 > 0.012 < C 8.9×10-4
【解析】
(1)NH3与O2在加热和催化剂作用下生成N2O,类似于生成NO的反应,同时生成水;
(2)根据已知焓变的热化学方程式推导所求反应,再由盖斯定律计算所求反应的焓变;
(3)总反应分两步进行Fe+N2O=FeO+N2,根据催化剂定义,第一步生成中间产物,第二步反应中,中间产物(FeO+)氧化CO生成CO2本身被还原成Fe+,根据催化剂定义,第二步反应对总反应速率没有影响,说明第一步是慢反应,控制总反应速率;
(4)①升高温度,平衡向吸热方向移动;②根据v= ![]() 计算O2的反应速率;恒温条件下,缩小体积,平衡向气体总物质的量减小的方向移动;③容器内混合气体密度为ρ=
计算O2的反应速率;恒温条件下,缩小体积,平衡向气体总物质的量减小的方向移动;③容器内混合气体密度为ρ=![]() ,据此分析解答;④根据方程式计算平衡时各组分的浓度,代入平衡常数表达式计算。
,据此分析解答;④根据方程式计算平衡时各组分的浓度,代入平衡常数表达式计算。
(1)NH3与O2在加热和催化剂作用下生成N2O和水,反应的化学方程式为2NH3+2O2 ![]() N2O+3H2O,故答案为:2NH3+2O2
N2O+3H2O,故答案为:2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
(2)①2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) △H1,②4NH3(g)+3O2(g)=2N2(g)+6H2O(1) △H2,根据盖斯定律,将(①×2-②)×![]() 得到N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) △H=
得到N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) △H=![]() △H1-
△H1-![]() △H2,故答案为:
△H2,故答案为:![]() △H1-
△H1-![]() △H2;
△H2;
(3)总反应N2O(g)+CO)(g)CO2(g)十N2(g)分两步进行,第一步:Fe++N2OFeO++N2,第二步反应中,中间产物(FeO+)氧化CO生成CO2本身被还原成Fe+,FeO++COFe++CO2,第二步反应对总反应速率没有影响,说明第一步是慢反应,控制总反应速率,第二步反应速率大于第一步反应速率,则第二步反应活化能小于第一步反应的活化能,故答案为:FeO++COFe++CO2;小于;
(4)①根据图乙,升高温度,N2O的转化率升高,说明升高温度,平衡向正反应方向移动,则正反应为吸热反应,则△H>0,故答案为:>;
②

所以v(O2)=![]() =
=![]() =
=![]() =0.012mol/(Lmin);容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,则缩小体积,压强增大,平衡向逆方向移动,即起始反应速率:v正(N2O)<v逆(N2O),故答案为:0.012;<;
=0.012mol/(Lmin);容器Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,则缩小体积,压强增大,平衡向逆方向移动,即起始反应速率:v正(N2O)<v逆(N2O),故答案为:0.012;<;
③容器内混合气体密度为ρ=![]() ,反应前后质量守恒,m不变,只需比较容器体积即可,从A→B→C,三点起始量一样,随着温度升高,由于反应为吸热反应,温度升高有助于反应进行,导致转化率增大,现要使三点的转化率一致,所以需要加压,相当于缩小容器体积,即VA>VB>VC,所以ρA<ρB<ρC,即图中A、B、C三点处容器内密度最大的点是:C,故答案为:C;
,反应前后质量守恒,m不变,只需比较容器体积即可,从A→B→C,三点起始量一样,随着温度升高,由于反应为吸热反应,温度升高有助于反应进行,导致转化率增大,现要使三点的转化率一致,所以需要加压,相当于缩小容器体积,即VA>VB>VC,所以ρA<ρB<ρC,即图中A、B、C三点处容器内密度最大的点是:C,故答案为:C;
④容器I的体积为10L,370℃时,N2O的转化率为40%,

所以K= =
=![]() =8.9×10-4,故答案为:8.9×10-4。
=8.9×10-4,故答案为:8.9×10-4。