题目内容
【题目】某化学兴趣小组在学习了电解质的有关知识后,老师提出了一个“电解质水溶液导电能力的强弱的影响因素”的课题。让该小组来完成课题的研究,已知HCl在水中能完全电离。
(1)该小组同学首先用密度为1.049 g·cm-3的乙酸(CH3COOH)和质量分数为36.5%,密度为1.18 g·cm-3的浓盐酸分别配制1 mol/L CH3COOH溶液和1 mol/L HCl溶液各500 mL,则他们应该量取乙酸和浓盐酸的体积分别为_________和__________;
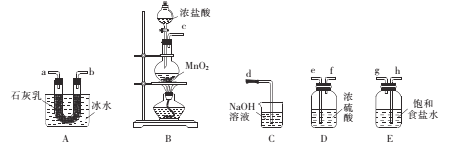
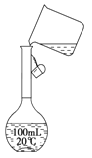
(2)某同学在配制500 mL 1 mol/L的CH3COOH溶液时,向容量瓶中转移溶液时操作如图所示,图中的错误有__________________________________________;
(3)他们首先用下图所示装置测1 mol/L的CH3COOH溶液和1 mol/L HCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,有同学认为乙酸是弱电解质,你_______(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是_______________________________________
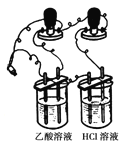
(4)他们又用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,有同学认为NaOH是弱电解质,你___________(填“同意”或“不同意”)他的观点,通过该现象你得到的结论是_______________________________________;
(5)通过上述探究实验,你能得到的结论是_______________________________________
【答案】28.6 mL 42.4 mL 未用玻璃棒引流 未采用500 mL容量瓶 同意 阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强 不同意 当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强 电解质溶液的导电能力是由单位体积内自由移动离子数目和离子所带电荷数目共同决定
【解析】
(1)两种溶液的溶质的量相等,根据据V=![]() 进行计算,注意盐酸溶液中0.5×36.5不是溶液的质量。
进行计算,注意盐酸溶液中0.5×36.5不是溶液的质量。
(2)转移溶液应该用玻璃棒进行引流,配制500mL溶液应该选用500mL容量瓶;
(3)醋酸和盐酸电离出的阴阳离子所带电荷均相同;阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强;
(4)电解质溶液导电能力与溶液中离子浓度及离子所带电荷有关;当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强,铜离子、硫酸根离子带有的电荷数大于钠离子、氢氧根离子带有的电荷数,因此用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,不能确定NaOH是弱电解质;
(5)根据(3)(4)探究实验的现象得出结论。
(1)两种溶液的溶质均为0.5L×1mol/L=0.5mol;根据V=![]() 可知,乙酸溶液的体积:V=
可知,乙酸溶液的体积:V=![]() =28.6mL;盐酸溶液的体积为:
=28.6mL;盐酸溶液的体积为:![]() =42.4mL;
=42.4mL;
(2)转移溶液应该用玻璃棒进行引流,配制500mL溶液应该选用500mL容量瓶;故答案是:未用玻璃棒引流;未采用500mL容量瓶;
(3)醋酸和盐酸电离出的阴阳离子所带电荷均相同;阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强,因此用图示装置测1mol/L的CH3COOH溶液和1mol/LHCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,可以得出乙酸是弱电解质的结论;
(4)硫酸铜和氢氧化钠电离出的离子数目相同,当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强,铜离子、硫酸根离子带有的电荷数大于钠离子、氢氧根离子带有的电荷数,因此用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,但不能确定NaOH是弱电解质;
(5)通过上述探究实验,得到的结论是电解质溶液的导电能力是由单位体积内自由移动离子数目和离子所带电荷数目共同决定。

 名校课堂系列答案
名校课堂系列答案